Biochemistry Module
Greening Across the Chemistry Curriculum English | Versión en Español  | Versão em Português (Brasil)
| Versão em Português (Brasil) 
Un Módulo de Química Verde
Sugerencia: Incluir en un curso de bioquímica durante la exposición de cinética y mecanismos enzimáticos o de la fosforilación oxidativa.
Una nueva familia de Insecticidas químicos representada por CONFIRM, agente de control selectivo de orugas, y los agentes relacionados MACH 2 e INTREPID, ofrecen una alternativa "Verde" frente a los insecticidas convencionales más usados
Joan Wasilewski, Chemistry Department, University of Scranton
joan.wasilewski@scranton.edu
* La versión en español ha sido realizada por los profesores Dra. Mª de la Concepción F. Ling Ling y Sebastián O. Pérez Báez del Dpto. de Ingeniería de Procesos, E.T.S.I.I., Universidad de Las Palmas de Gran Canaria, España. Revisión técnica realizada por el bioquímico y biólogo molecular Juan A. Sánchez de Ocaña Eléxpuru.
Introducción
Los insecticidas se emplean en la industria agrícola para prevenir la propagación de la destrucción de plantas. Existen varios tipos de insecticidas. Los que trataremos a continuación incluyen los organofosfatos y carbamatos, que son agentes químicos ampliamente usados y cuyo efecto principal es la inhibición de la enzima relacionada con la regulación de la transmisión nerviosa; y la rotenona, producto químico cuyos efectos se relacionan con la inhibición de una enzima encontrada en la cadena transportadora de electrones. Aunque estos tipos de sustancias químicas son efectivos contra los insectos, pueden tener efectos tóxicos en otros organismos.
Rohm y Haas han desarrollado una nueva familia de insecticidas que no sólo es efectiva contra los insectos, sino que además presentan un nivel de selectividad superior al que con frecuencia se encuentra en otros insecticidas. Rohm y Haas han recibido el premio de La Presidencia a los Retos de la Química Verde, por la producción de estos insecticidas (CONFIRM, INTREPID, y MACH 2). (1) Uno de ellos, el CONFIRM, ha sido clasificado por la Agencia de Protección Medioambiental de los E.U. como un plaguicida de bajo riesgo.
En este módulo expondremos el modo de acción idividual de estos tipos de insecticidas.
Antecedentes
Los plaguicidas son sustancias empleadas para prevenir o reducir la proliferación de las plagas, como los insectos, microbios, roedores, algas, peces, plantas, etc. Podemos encontra una extensa lista de aplicaciones de plaguicidas en la página web de la Agencia de Protección Medioambiental de los EE.UU. https://www.epa.gov/opp00001/whatis.htm
El uso más común de los insecticidas es en la agricultura y jardinería. También los podemos encontrar en productos diseñados para la protección contra pulgas y garrapatas y el control general de insectos.
Las áreas de trabajo implicadas en el empleo de plaguicidas incluye la contaminación medioambiental y la no selectividad. La contaminación del agua de abasto puede tener efectos tóxicos sobre las plantas y la fauna en el área colindante. Igualmente la contaminación de los alimentos producidos pueden transmitir sus efectos. Es importante recordar que los plaguicidas actúan suprimiendo algún mecanismo biológico importante del organismo al que va dirigido. Sin embargo, debido a que las secuencias metabólicas que tienen lugar en las células son muy similares de un organismo a otro, los plaguicidas puden presentar una amenaza también para aquellos organismos a los que no van dirigidos. Si estos organismos a los que no va dirigidos son el hombre, la fauna o la vida vegetal; el empleo de los plaguicidas puede plantear una amenaza al medio ambiente, que debe ser estimado cuidadosamente. Una importante consideración es la selección del plaguicida. Un plaguicida que sea altamente selectivo para el organismo al que va dirigido planteará un menor riesgo para el medio ambiente.
Ejemplos de Plaguicidas
*organofosfatos
Uno de los tipos de insecticidas más ampliamente usados son los organofosfatos. Estos constituyen aproximadamente la mitad de los insecticidas empleados en los Estados Unidos (2). Los organofosfatos inhiben de forma irreversible la acción de una importante enzima como es la acetilcolinesterasa, que regula los niveles del neurotransmisor acetilcolina. Algunos organofosfatos puede ser altamente tóxicos y están químicamente relacionados con los gases nerviosos. Otros son considerablemente menos tóxicos.
* carbamatos
Los Carbamatos constituyen otro tipo de plaguicidas. Al igual que los organofosfatos inhiben la acetilcolinesterasa, pero de forma reversible.
* rotenona -- un plaguicida vegetal
La Rotenona proviene de las raices, semillas y hojas de diversas plantas por lo que nos podemos referir a ella como plaguicida botánico. Es un plaguicida no específico que se emplea para el control de insectos tanto en plantas como en animales domésticos, así como en la población piscícola. (3) La Rotenona es inhibidor de una enzima de uno de los complejos relacionados con la oxidación del NADH en la cadena transportadora de electrones.
*diacilhidrazinas--aceleradores de la muda (QUÍMICA VERDE)
Las diacilhidrazinas se utilizan para combatir una hormona esteroide de los insectos, la 20-hidroxiecdisona (un ecdiesteroide). Se sospecha que esta hormona esteroide está relacionada con la regulación de la expresión genética del genoma del insecto. El efecto de la interrupción en el proceso de muda de los insectos a los que va dirigidos les supone la muerte.
Modos de Acción
Inhibición de la Acetilcolinesterasa
Función de la acetilcolina
Tanto los organofosfatos como los carbamatos actúan inhibiendo la enzima acetilcolinesterasa, que cataliza la hidrólisis de la acetilcolina a colina y acetato. La acetilcolina es un nuerotransmisor sintetizado por la neuronas transmisoras o presinápticas. Se encuentra almacenado en las vesículas presinápticas hasta que un potencial de acción provoca una despolarización de la membrana plasmática de dichas células. Como resultado se produce una entrada de iones Ca2+ seguido por una fusión de las vesículas sinápticas con la membrana plasmática. Se libera la acetilcolina por las fisuras sinápticas y se difunde hacia el receptor, o célula postsináptica. Aquí, la acetilcolina se enlaza con su receptor, el cual actúa como un canal catiónico. El receptor experimenta una cambio enlazando la acetilcolina. Este cambio en su estructua tridimensional produce una entrada de Na+ que despolariza la membrana plasmática de la célula postsináptica, iniciándose un potencial de acción.
Es necesario que la acetilcolina sea eliminada de la fisura sináptica antes de que la sinápsis sea capaz de responder a una nueva señal. Ello requiere la acción de la acetiIcolinesterasa que cataliza la siguiente reacción:
acetilcolina + H2O ----------> colina + acetato
La colina es absorbida por las células presinápticas y empleada en la síntesis de más acetilcolina, mientras que el acetato es transportado a otros tejidos y metabolizado.
catálisis de la acetilcolinesterasa
Las enzimas son catalizadores biológicos. Por consiguiente, aumentan la velocidad de una reacción química sin consumirse. La mayoría de las enzimas son altamente específicas en relación a la reacción que van a catalizar. La reacción catalizada por la acetilcolinesterasa se muestra debajo:
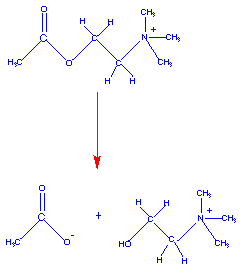
El diagrama siguiente muestra el enlace de la acetilcolina en el centro activo de la acetilcolinesterasa y la catálisis que tiene lugar:
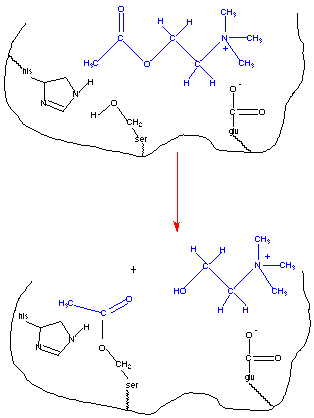
Esta figura representa el enlace de la acetilcolina en el centro activo de la acetilcolinesterasa. Las cadenas laterales de aminoácidos juegan un papel importante en la formación del complejo enzima-sustrato y más directamente en el proceso catalítico. El primer paso en una reacción catalizada por cualquier enzima es el enlace del sustrato al centro activo de la enzima, lo cual está facilitado por las interacciones entre el sustrato y las cadenas laterales amino-acilo de la enzima. Con frecuencia son interacciones no covalentes que incluyen atracciones electrostáticas, enlaces por puente de hidrógeno y enlaces van der Waals. Los residuos cargados negativamente pueden interactuar favorablemente con el grupo amino cargado positivamente. El residuo de histidina se encuentra cercano al de serina pudiendo estabilizar la conformación del centro activo mediante un puente de hidrógeno. De hecho la actividad de la enzima depende del pH, con una actividad máxima a pH cercano al valor del pKa del residuo de histidina (4). Además de la implicación de los residuos de aminoácidos en la formación del complejo enzima-sustrato, se encuentran los relacionados más directamente con la catálisis. Nótese que los resiuduos de serina están localizados en el centro activo. Su grupo nucleófilo hidroxilo reacciona con el carbono del grupo acilo de la acetilcolina. La serina es acetilada y la colina abandona el grupo.
Las enzimas, como catalizadores, no se consumen durante el curso de la reacción; y pueden ser regenerados antes de que la reacción se complete. En la siguiente figura, el residuo de serina acetilada debe ser hidrolizada antes de que la reacción se complete, siendo la enzima capaz de catalizar una nueva reacción.
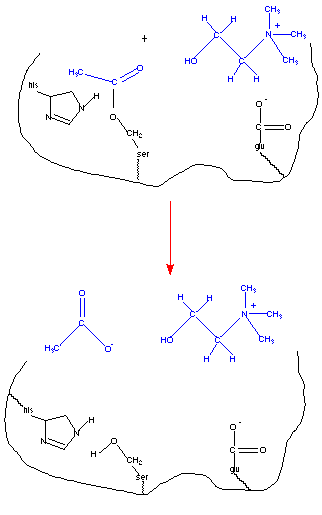
Como resultado de la hidrólisis del residuo de serina acetilado, se forma acetato. Una vez que la colina y el acetato se separan del centro activo, la enzima es capaz de enlazarse con más sustrato y repetir la catálisis de la reacción.
inhibición de la enzima por organofosfatos y carbamatos
Los inhibidores son sustancias que interactúan con la enzima reduciendo su actividad. Pueden tener carácter reversible o irreversible dependiendo del tiempo de vida del complejo enzima/inhibidor. Los organofosfatos son inhibidores irrevesibles que reaccionan con el centro activo del residuo de serina manteniéndose ligados a ella. La reacción de los carbamatos es similar, pero el complejo no tiene tan larga duración. Debajo se muestran las estructuras generales de los insecticidas organofosfatos y carbamatos.
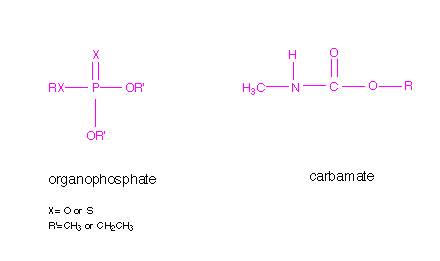
El grupo nucleófilo hidroxilo del residuo de la serina, localizado en el centro activo de la acetilcolinesterasa, reacciona con el fósforo del organofosfato mediante un enlace covalente. De la misma manera, el mismo grupo nucleófilo hidroxilo reacciona con el carbono del grupo carbonilo mediante un enlace covalente, similar a la reacción con la acetilcolina. En el caso de los inhibidores irresversibles se les considera como inhibidores suicidas. A continuación se representa un diagrama del enlace covalente entre el organofosfato y el carbamato con el residuo de serina en el centro activo de la acetilcolinesterasa.
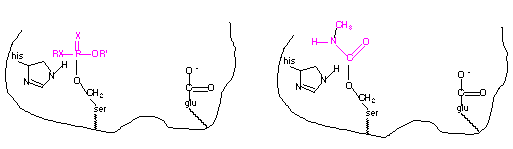
Los organofosfatos y carbamatos también pueden inhibir la acción de la acetilcolinesterasa de los organismos a los cuales no van dirigidos, incluidos los mamíferos. Su aguda toxicidad se debe al efecto que producen sobre el sistema nervioso de los animales.
Inhibición de la cadena de transporte de electrones
la cadena transportadora de electrones y la fosforilación oxidativa
En los organismos quimiotróficos, la energía se obtiene de la oxidación de las moléculas orgánicas. Los combustibles metabólicos como los carbohidratos, grasas y proteínas sufren una serie de reacciones y con frecuencia son oxidados a dióxido de carbono. La mayor parte de la energía liberada en caminos reactivos tales como el ciclo TCA (ciclo de Krebs) y la b-oxidación de los ácidos grasos está en forma de cofactores reducidos como el dinucleótido nicotinamida adenina (NADH) y el dinucleótido flavina adenina (FADH2). El trifosfato de adenosina (ATP), es la reserva energética de las células, que se produce en la mitocondria mediante una serie de reacciones iniciadas por la oxidación del NADH o del FADH2. A estas reacciones se las describe como de fosforilación oxidativa e incluye una serie de reacciones de oxidación/reducción en la cadena transportadora de electrones. La energía producida durante la oxidación exergónica del NADH se utiliza para forzar la fosforilación energéticamente desfavorable del difosfato de adenosina, produciendo ATP. El ATP se utiliza para llevar a cabo muchas reacciones energéticamente desfavorables en el cuerpo. La hidrólisis de un enlace terminal fosfoanhidrido es altamente exergónico. Puede emplearse esta energía para la contracción muscular y para mantener gradientes de concentración (y otros muchos ejemplos).
A continuación se muestra un diagrama del transporte de electrones que tiene lugar durante la oxidación del NADH.
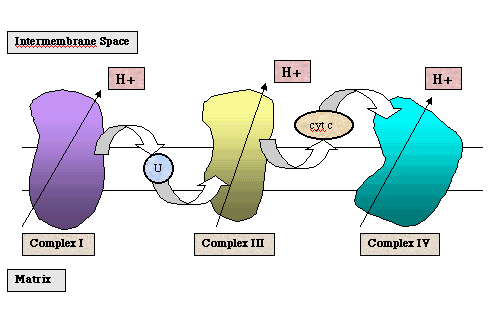
La fosforilación oxidativa tiene lugar en la mitrocondria, un orgánulo de doble membrana. La oxidación del NADH o del FADH2 se produce dentro de los complejos proteínicos de la cadena transportadora de electrones. Estos complejos contienen portadores de electrones tales como las flavinas, los centros hierro-sulfuro, los hemos (que contienen hierro) y el cobre. Estos se encuentran embebidos dentro de la membrana interna de la mitocondria. La membrana interna separa la matriz mitocondrial, químicamente distinta, y el espacio intermembranoso.
Durante la oxidación del NADH, los electrones entran en el complejo I de la cadena de transporte de electrones (al cual se refiere también como NADH deshidrogenasa o NADH-Q reductasa). Como los electrones se mueven a través del complejo por medio de una serie de reacciones redox, los protones se liberan desde la matriz mitocondrial al espacio intermembranoso. Los electrones son transferidos a la primera molécula transportadora, la ubiquinona, designada como "U" en la figura inferior. La ubiquinona se reduce a ubiquinol que se difunde al Complejo III. Como los electrones se mueven a través del Complejo III (también referido como citocromo c reductasa), los protones son de nuevo liberados de la matriz mitocondrial al espacio intermembranoso. Los electrones se transfieren a una segunda molécula transportadora, el citocromo c. El citocromo c reducido se difunde al Complejo IV (también conocido como citocromo oxidasa). De nuevo los protones son liberados. El último aceptor de electrones es la molécula de oxígeno que se reduce a agua.
El movimiento de protones desde la matriz mitocondrial al espacio intermembranoso genera un potencial electroquímico a través de la membrana mitocondrial interna. El gradiente de protones que se origina a través de la membrana interna es requerido por la enzima ATP sintasa, que también contiene una fuente de protones. Después de la fosforilación del ADP, la enzima debe liberar el ATP. Esta liberación depende de la presencia de un gradiente de protones. A este proceso se le llama teoría quimiosmótica.
La serie de reacciones que tienen lugar en la cadena de transporte de electrones producen un gradiente de protones que se requiere para la liberación del ATP de la ATP sintasa. Estos procesos están acoplados, de manera que si se encuentrara presente un inhibidor de la cadena de transporte de electrones, afectaría negativamente a la producción de ATP.
rotenona
El plaguicida botánico Rotenona, es un inhibidor de una de las enzimas del Complejo I de la cadena de transporte de electrones. En presencia de éste insecticida, los electrones procedentes del NADH no pueden entrar en la cadena de transporte de electrones, teniendo como consecuencia la imposibilidad de obtener ATP a partir de la oxidación del NADH. La enzima inhibida por la rotenona es la NADH deshidrogenasa. La rotenona afecta a la respiración celular y también la coordinación muscular. La estructura química de la rotenona se muestra debajo.
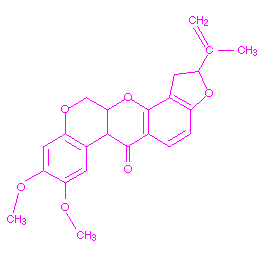
Aceleradores de la muda
Los aceleradores de la muda, entre los que se incluyen el tebufenóxido y la halofenozida, son un tipo de insecticidas relativamente nuevo y altamente específicos para los Lepidópteros. Estas diacilhidrazinas provocan la destrución de la hormona esteroidal 20-hidroxiecdisona (un ecdisteroide) del insecto, la cual se requiere para el proceso de muda. El efecto de este tipo de insecticidas es el de interrumpir el proceso de muda de los insectos a los que va dirigidos, dando como resultado su destrucción. Al ser reguladores de crecimiento de los insectos, son más selectivos que los organofosfatos, los carbamatos y las rotenonas. Sin embargo, también presentan algunos efectos perjudiciales sobre los organismos a los que no van dirigidos.
la ecdisona y receptores de la ecdisona
El esteroide 20-hidroxiecdisona es una hormona de desarrollo que se halla en los artrópodos. El proceso de muda está regulado por la variación de su concentración en la larva (5). El aumento en los niveles de esta hormona dan lugar al inicio de la muda. Cuando la larva entra en el estado de muda, se paraliza la alimentación y el fluido de muda que contiene distintas enzimas proteolíticas necesarios para la misma entra en el espacio ecdisial. En este punto, las células epidérmicas empiezan una fase de aumento en la síntesis de proteínas (expresión del gen) produciéndose una nueva cutícula. La reducción en la concentración de la 20-hidroxiecdisona pone en funcionamiento la fase siguiente que incluye la activación de las enzimas en el fluido de muda, digestión de la procutícula y reabsorción del fluido de muda. Con una posterior reducción en la concentración de la 20-hidroxiecdisona, se liberan otras hormonas que se requieren para completar el proceso de muda, reiniciándose entonces la alimentación.
El crecimiento y desarrollo adecuado de los insectos depende de la concentración de la 20-hidroxiecdisona en distintos estados diferenciados. Se sugiere que esta hormona esteroide está relacionada con la regulación de la expresión genética del genoma del insecto.
Normalmente, las hormonas interactúan con receptores específicos antes de iniciar un efecto fisiológico. El ecdiesteroide obliga a una proteína receptora ecdiesteroide a regular los tipos de genes de expresión temprana y tardía. (Existen numerosos ejemplos de este tipo de regulación temporal en los sistemas bioquímicos. Algunos de los más sencillos se encuentran en una variedad de sistemas víricos). Los genes "tempranos" son activados por el complejo hormona/receptor. Las proteínas obtenidas a partir de la traducción de los genes tempranos, reprimen la transcripción de estos mismos genes activando simultáneamente la transcripción de los genes "tardíos". Algunos de los productos de los genes "tempranos" son los factores de transcripción. Estos factores son proteínas que pueden vincularse a secuencias de nucleóticos cortas, dando lugar al inicio o regulación de la transcripción.
diacilhidrazinas-- insecticidas "verdes"
Algunas diacilhidracinas pueden imitar a la hormona esteroidal del insecto 20-hidroxiecdisona. A continuación se muestran las estructuras de la 20-hidroxiecdisona y las diacilhidrazinas tebufenozida y halofenozida.
Estos insecticidas son capaces de unirse con las proteínas del receptor ecdisteroide. Mientras que la expresión genética, que depende de la presencia de la 20-hidroxiecdisona, tiene lugar en presencia de las diacilhidrazinas; se impide la expresión genética que depende de la ausencia de la 20-hidroxiecdisona (5). El efecto tóxico de las diacilhidrazinas se debe no sólo al hecho de que imitan a la 20-hidroxiecdisona, sino también a que sus niveles no se reducen.
Rohm y Haas utilizan la tebufenocida en el insecticida CONFIRM. Esta diacilhidrazina es selectiva para los insectos lepidópteros. Es un plaguicida altamente selectivo, con una toxicidad mínima para los organismos a los que no va dirigido, incluidos los insectos no lepidópteros. En presencia de la tebufenocida, el proceso de muda comienza, pero en aquellos momentos del proceso en que los niveles de 20-hidroxiecdisona normalmente disminuirían, la tebufenocida permanece. Se altera el proceso de muda y la alimentación no tiene lugar, dando como resultado la muerte. Rohm y Haas emplean la halofenozida, otra diacilhidrazina, en el insecticida MACH2. Su modo de acción es similar al de la tebufenocida. Sin embargo, se aplica a otros organismos, en concreto los gusanos del césped.
Como se indicó previamente, Rohm y Haas han recibido uno de los Premios de La Presidencia a los Retos de la Química Verde por su trabajo con éstos insecticidas, y el CONFIRM ha sido clasificado como un plaguicida de bajo riesgo por por la U.S. E.P.A.
Conclusión
Existe una variedad de mecanismos mediante los cuales los insecticidas pueden erradicar las poblaciones de los organismos a los que van dirigidos. Los insecticidas permiten un aumento en la producción de los cultivos siendo por tanto fundamentales para la industria agrícola. Algunos insecticidas actúan dañando los procesos bioquímicos, que son comunes a muchos tipos de organismos. Los ejemplos a los que nos hemos referido aquí han sido los inhibidores de la acetilcolinesterasa y un inhibidor de la enzima encontrada en la cadena de transporte de electrones de la fosforilación oxidativa. Los efectos potenciales no deseables sobre el medio ambiente son mayores para este tipo de insecticidas que para aquellos que son más especificos, como los aceleradores de la muda.
Cuestiones
1. ¿Qué reacción química está catalizada por al acetilcolinesterasa?
2. Nombre dos tipos de insecticidas que afecten a la actividad de la acetilcolinesterasa. ¿Cuál es su modo de acción?
3. Comente las semejanzas y diferencias en las formas de actuación de los insecticidas organofosfatos y carbamatos.
4. ¿Por qué es importante convertir rápidamente a la acetilcolina en colina y acetato?
5. ¿Cuáles son las consecuencias de la desactivación de la acetilcolinesterasa?
6. Describa el papel de la acetilcolina en la neurotransmisión.
7. ¿Cuál es la misión del residuo de serina en el centro activo de la acetilcolinesterasa?
8. ¿Cómo influye la oxidación del NADH en el aumento de la cantidad de ATP disponible para las células?
9. ¿Cuál es el efecto de añadir rotenona a un sistema donde tiene lugar una fosforilación oxidativa?
10. Como los electrones se mueven desde el NADH a través de la cadena de transporte de electrones, ¿cuál es el efecto sobre el pH de la matriz mitocondrial?
11. Comente el papel de la 20-hidroxiecdisona en el desarrollo del insecto.
12. ¿Cómo influyen las diacilhidrazinas en el desarrollo del insecto?
13. ¿Cuál es la ventaja de utilizar un insecticida que sea más específico para la población a la que va dirigido?
14. Explique por qué los insecticidas organofosfatos pueden ser más agudamente tóxicos que las dizcilhidrazinas, sobre los trabajadores que los manipulan.
Referencias Bibliográficas
1. Cann, M. C. and Connelly, M. E., Real World Cases in Green Chemistry,
American Chemical Society: 2000
2. Organophosphate Pesticides in Food.
https://ww.epa.gov/oppsrrd1/op/primer.htm(accessed June 2000)
3. Extoxnet. https://www.pmep.cce.cornell.edu/profiles/extoxnet/pyrethrins-ziram/
rotenone-ext.html (accessed July 2000)
4. https://wcb.ucr.edu/schools/CNAS/entm/tmiller/1/modules/page22.html (accessed August 2000)
5. Dhadialla, T. S., Carlson, G. R., and Le, D. P., New Insecticides with Ecdysteroidal and Juvenile Hormone
Activity. Annu. Rev. Entomol. 1998, 43, 545-569.