Biochemistry Module
Greening Across the Chemistry Curriculum English | Versión en Español  | Versão em Português (Brasil)
| Versão em Português (Brasil) 
Um Módulo de Química Verde
Uso Sugerido: Disciplina de bioquímica, durante a discussão de cinética dos mecanismos enzimáticos ou de fosforilação oxidativa.
Uma Nova Família de Inseticidas Químicos Representada pelo CONFIRM, Agente de Controle Seletivo de Lagartas e os Agentes Relacionados, MACH 2 e INTREPID, Oferece uma Alternativa “Verde” para Alguns dos Inseticidas Convencionais Mais Usados
Joan Wasilewski, Chemistry Department, University of Scranton
joan.wasilewski@scranton.edu
Introdução
Os inseticidas são usados na agroindústria para prevenir a propagação da destruição das plantas. Existe uma variedade de classes de inseticidas que são usados. A discussão abaixo inclui os organofosforados e carbamatos, que são produtos químicos largamente usados e, cujo efeito principal, é a inibição de uma enzima envolvida na regulação da transmissão nervosa; e a rotenona, uma substância química cujo efeito envolve a inibição de uma enzima encontrada na cadeia de transporte de elétrons. Embora estas classes de produtos químicos sejam eficazes contra os insetos, elas podem causar efeitos tóxicos em outros organismos.
Uma nova família de inseticidas, desenvolvida pela Rohm and Haas, não apenas é eficaz contra insetos, mas oferece também um nível mais alto de seletividade em relação ao que às vezes é encontrado em outros inseticidas. A Rohm and Haas recebeu o Prêmio Presidencial Desafio em Química Verde pelo desenvolvimento destes inseticidas (CONFIRM, INTREPID e MACH 2). (1) Um dos inseticidas, o CONFIRM, foi classificado pela Agência de Proteção Ambiental dos Estados Unidos (EPA) como um pesticida de risco reduzido.
Neste módulo, será discutido o mecanismo de ação de cada uma destas classes de inseticidas.
Histórico
Os pesticidas são substâncias usadas para prevenir ou reduzir a proliferação de pragas, como, por exemplo, insetos, micróbios, roedores, algas, peixes, plantas, etc. Uma lista mais extensa de alvos para os pesticidas pode ser vista no “web site” da Agência de Proteção Ambiental dos Estados Unidos, em https//www.epa.gov/opp00001/whatis.htm. O uso mais comum dos inseticidas é na agricultura e na jardinagem. Os inseticidas também são encontrados em produtos indicados para a proteção contra carrapatos e pulgas e para o controle de insetos de uma maneira geral.
Alguns temas preocupantes quando se trabalha com pesticidas incluem a contaminação ambiental e a falta de seletividade. A contaminação do suprimento de água pode ter efeitos tóxicos sobre as plantas e a fauna nas áreas onde o inseticida é administrado. Além disso, a contaminação dos alimentos produzidos também pode disseminar os efeitos. É importante ter em mente que os pesticidas atuam suprimindo algum mecanismo biológico importante no organismo alvo. Contudo, como a série de processos metabólicos que ocorrem nas células é muito semelhante de um organismo para outro, os pesticidas podem representar uma ameaça também para os organismos que não são alvos. Estes organismos que não são alvos podem ser tanto o homem, a fauna ou a flora; o uso de pesticidas pode representar uma ameaça ao ambiente que deve ser considerada com cuidado. A escolha do pesticida é importante. Um pesticida que é altamente seletivo a um dado organismo, poderá representar um menor risco para o ambiente.
Exemplos de Pesticidas
*organofosforados
Uma das classes de inseticidas mais utilizadas é a dos organofosforados. Eles contribuem, aproximadamente, com a metade dos inseticidas usados nos Estados Unidos (2). Os organofosforados inibem irreversivelmente a enzima acetilcolinesterase, que é importante na regulação dos níveis de acetilcolina, um neurotransmissor. Alguns organofosforados podem ser altamente tóxicos e estão quimicamente relacionados com os gases nervosos. Outros são consideravelmente menos tóxicos. Uma lista de pesticidas organofosforados, incluindo nomes comuns e comerciais, pode ser encontrada emhttps//www.epa.gov/oppbrad1/matrices/oplist.htm.
* carbamatos
Os carbamatos constituem outra classe de pesticidas. Eles inibem a acetilcolinesterase, como fazem os organofosforados, mas de maneira reversível.
*um pesticida de origem vegetal - rotenona
A rotenona é derivada de raízes, sementes e folhas de várias plantas e é considerada um pesticida botânico. É um pesticida não específico usado para o controle de insetos tanto em plantas quanto em animais domésticos, assim como para o controle de populações de peixes. (3) A rotenona é inibidora de uma enzima de um dos complexos envolvidos com a oxidação do NADH na cadeia transportadora de elétrons.
*aceleradores de muda – diacil-hidrazinas (QUÍMICA VERDE)
As diacil-hidrazinas são agonistas do hormônio esteroidal dos insetos, a 20-hidroxiecdisona (um ecdiesteróide). É provável que este hormônio esteroidal esteja envolvido na regulação da expressão genética do genoma do inseto. O efeito é a interrupção do processo de muda dos insetos alvos, resultando na morte dos mesmos.
Mecanismos de Ação
Inibição da Acetilcolinesterase
Função da acetilcolina
Tanto os organofosforados quanto os carbamatos atuam na inibição da enzima acetilcolinesterase, que catalisa a hidrólise da acetilcolina para colina e acetato. A acetilcolina é um neurotransmissor sintetizado pela célula transmissora ou pré-sináptica. Ela é armazenada em vesículas sinápticas até que um potencial de ação leve a uma despolarização da membrana plasmática das células pré-sinápticas. Isto resulta na entrada de Ca2+ seguida pela fusão de vesículas sinápticas com a membrana plasmática. A acetilcolina é liberada na fenda sináptica e se difunde até o receptor, a célula pós-sináptica. Aqui, a acetilcolina se liga ao seu receptor, que pode atuar como um canal catiônico. O receptor sofre uma mudança conformacional logo após se ligar à acetilcolina. Esta mudança na estrutura tridimensional resulta em uma entrada de Na+, que despolariza a membrana plasmática na célula pós-sináptica. Tem início um potencial de ação. É necessário que a acetilcolina seja removida da fenda sináptica antes que a sinapse seja capaz de responder a outro sinal. Isto requer a ação da acetilcolinesterase, que catalisa a reação abaixo:
acetilcolina + H2O ----------> colina + acetato
A colina é absorvida pelas células pré-sinápticas e usada na síntese de mais acetilcolina. O acetato é transportado para outros tecidos e metabolizado.
A catálise pela acetilcolinesterase
As enzimas são catalisadores biológicos. Como tais, aumentam a velocidade de uma reação química sem serem consumidos. A maioria das enzimas é altamente específica em relação à reação a ser catalisada. A reação catalisada pela acetilcolinesterase é mostrada abaixo:
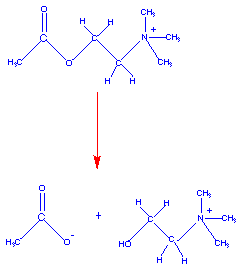
The diagram below shows the binding of acetylcholine to the active site of acetlycholinesterase and the catalysis at the active site:
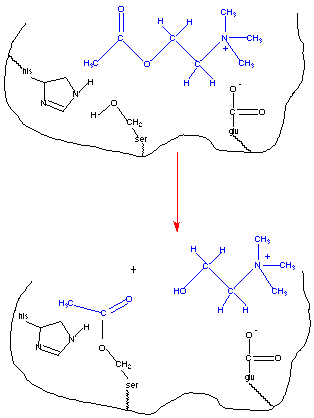
Esta figura ilustra a ligação da acetilcolina ao sítio ativo da acetilcolinesterase. As cadeias laterais de aminoácidos exercem importantes funções na formação do complexo enzima-substrato e, mais diretamente, no processo catalítico. O primeiro passo, em qualquer reação envolvendo catálise enzimática, é a ligação do substrato ao sítio ativo da enzima. Isto é facilitado pelas interações entre o substrato e as cadeias laterais amino-acila na enzima. Em geral, estas interações não são covalentes e incluem atrações eletrostáticas, ligações de hidrogênio e atrações de van der Waals. Os fragmentos carregados negativamente podem interagir de maneira favorável com os grupos amino, carregados positivamente. O fragmento histidina está próximo do fragmento serina e pode estabilizar a conformação do sítio ativo através de ligações de hidrogênio. De fato, a atividade enzimática depende do pH, e tem um valor máximo em um pH consistente com o valor do pKa de um fragmento histidina (4). Além dos fragmentos de aminoácidos envolvidos na formação do complexo enzima-substrato, há aqueles que estão envolvidos mais diretamente na catálise. Observe que o fragmento serina está localizado no sítio ativo. O seu grupo hidroxila nucleofílico reage com o carbono do grupo acila na acetilcolina. A serina é acetilada e a colina é o grupo de saída.
As enzimas, enquanto catalisadores, não são consumidas durante o curso da reação e precisam ser regeneradas antes que a reação se complete. Na figura abaixo, o fragmento serina acetilado precisa ser hidrolisado antes que a reação se complete, para que a enzima seja capaz de catalisar uma nova reação.
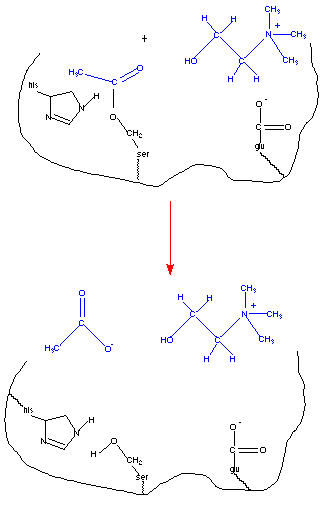
O resultado da hidrólise do fragmento serina acetilado é a formação de acetato. Uma vez que a colina e o acetato tenham deixado o sítio ativo, a enzima é capaz de ligar-se com mais substratos e repetir a reação catalítica.
Inibição enzimática, organofosforados e carbamatos
Os inibidores são substâncias que interagem com uma enzima, resultando numa diminuição na sua atividade. Os inibidores são denominados reversíveis ou irreversíveis, dependendo do tempo de vida do complexo enzima/inibidor. Os organofosforados são inibidores irreversíveis, que reagem com o fragmento serina do sítio ativo, permanecendo ligado a ele. A reação com carbamatos é semelhante, mas o complexo não tem uma vida longa. Abaixo são mostradas as estruturas gerais dos inseticidas organofosforados e carbamatos.
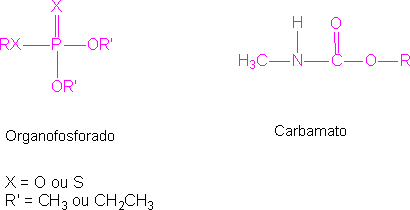
O grupo hidroxila nucleofílico do fragmento serina, localizado no sítio ativo da acetilcolinesterase, reage com o fósforo do organofosforado, levando a um organofosforado ligado covalentemente. Da mesma maneira, o mesmo grupo hidroxila nucleofílico reage com o carbono do grupo carbonila para formar um carbamato ligado covalentemente, semelhante ao que ocorre na reação com a acetilcolina. O resultado é a desativação da enzima, porque o grupo hidroxila não está mais disponível para atacar o substrato da aceticolina. No caso dos inibidores irreversíveis, ocorre a chamada inibição suicida. Abaixo é mostrado um diagrama de um organofosforado e um carbamato, ligados covalentemente a um fragmento de serina no sítio ativo da colinesterase.
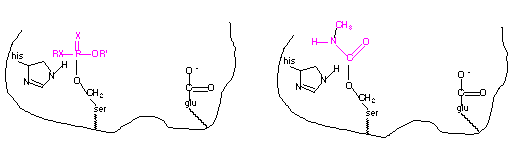
Os organofosforados e os carbamatos também podem inibir a acetilcolinesterase de organismos que não são os alvos, incluindo os mamíferos. A toxicidade aguda destas espécies é devida ao seu efeito causado no sistema nervoso dos animais.
Inibição da Cadeia de Transporte de Elétrons
A cadeia de transporte de elétrons e a fosforilação oxidativa
Em organismos quimiotrópicos, a energia é obtida a partir da oxidação de moléculas orgânicas. Combustíveis como os carboidratos, gorduras e proteínas, sofrem uma série de reações metabólicas e são, freqüentemente, oxidados a dióxido de carbono. A maior parte da energia liberada no decorrer de reações como o ciclo TCA e a oxidação b de ácidos graxos está na forma de cofatores reduzidos, como a nicotinamida-adenina-dinucleotídeo (NADH) e a flavina-adenina-dinucleotídeo (FADH2). A adenosina-trifosfato (ATP), fonte de energia das células, é produzida na mitocôndria por uma série de reações, começando com a oxidação do NADH ou FADH2. O conjunto destas reações é chamado de fosforilação oxidativa e inclui uma série de reações de oxidação/redução na cadeia transportadora de elétrons. A energia produzida durante a oxidação exergônica do NADH é usada para forçar a fosforilação da adenosina-difosfato, energeticamente desfavorável, fornecendo o ATP. O ATP é usado para promover muitas reações energeticamente desfavoráveis no organismo. A hidrólise da ligação terminal do fosfoanidrido é altamente exergônica. Esta energia pode ser utilizada na contração muscular e na manutenção dos gradientes de concentração (além de muitos outros exemplos).
Abaixo está um diagrama do transporte de elétrons que ocorre durante a oxidação do NADH.
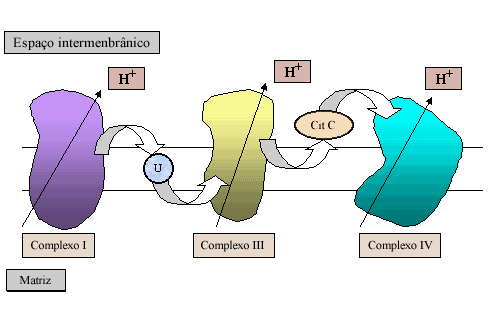
A fosforilação oxidativa acontece na mitocôndria, uma organela com dupla membrana. A oxidação do NADH ou do FADH2 ocorre dentro de complexos protéicos da cadeia transportadora de elétrons. Estes complexos contêm carregadores de elétrons, tais como flavinas, centros ferro-enxofre, hemes (que contêm ferro), e cobre. Eles estão incrustados dentro da membrana interna da mitocôndria. A membrana interna separa a matriz mitocondrial, quimicamente distinta, e o espaço intermembrânico.
Durante a oxidação do NADH, os elétrons entram na cadeia de transporte de elétrons no Complexo I (também conhecido como NADH desidrogenase ou NADH-Q redutase). Como os elétrons movem-se através do Complexo I, por meio de uma série de reações redox, os prótons são bombeados da matriz mitocondrial para dentro do espaço intermembrânico. Os elétrons são transferidos à primeira molécula transportadora, a ubiquinona, designada como “U” na figura acima. A ubiquinona é reduzida a ubiquinol, que se difunde até o Complexo III. Como os elétrons se movem através do Complexo III (também chamado de citocromo c redutase), os prótons são novamente bombeados da matriz mitocondrial para o espaço intermembrânico. Os elétrons são transferidos para a segunda molécula transportadora, o citocromo c (na figura, designado Cit C). O citocromo c reduzido se difunde até o Complexo IV (também chamado citocromo c oxidase). Novamente, prótons são bombeados da matriz mitocondrial para o espaço entre as membranas. O último aceptor de elétrons é o oxigênio molecular, que é reduzido para água.
O movimento dos prótons desde a matriz mitocondrial até o espaço intermembrânico gera um potencial eletroquímico através da membrana mitocondrial interna. O gradiente de prótons que é gerado através da membrana interna é utilizado pela enzima ATP sintase, que também contém uma bomba de prótons. Após a fosforilação de ADP, a enzima deve liberar o ATP. Esta liberação é dependente da presença de um gradiente de prótons. Este processo é conhecido como a teoria quimiosmótica.
A série de reações na cadeia de transporte de elétrons fornece um gradiente de prótons, que é necessário para a liberação de ATP pela ATP sintase. Estes processos estão acoplados. Então, se um inibidor da cadeia de transporte de elétrons estivesse presente, ele poderia afetar negativamente a produção de ATP.
rotenona
O pesticida botânico rotenona é um inibidor de uma das enzimas do Complexo I da cadeia de transporte de elétrons. Na presença deste inseticida, os elétrons provenientes do NADH não podem entrar na cadeia de transporte de elétrons, o que resulta na incapacidade de produzir ATP a partir da oxidação do NADH. A enzima inibida pela rotenona é a NADH desidrogenase. A rotenona afeta a respiração celular e pode também afetar a coordenação muscular. A estrutura química da rotenona é mostrada abaixo.
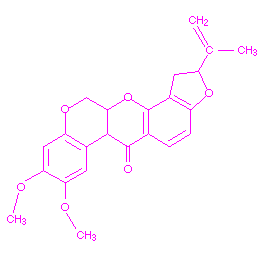
Os aceleradores de muda, incluindo o tebufenóxido e a halofenozida, são uma classe de inseticidas relativamente nova, que é altamente específica para os Lepidópteros. Estas diacil-hidrazinas são agonistas do hormônio esteroidal 20-hidroxiecdisona (um ecdiesteróide), que é necessário para o processo de muda do inseto. O efeito desta classe de inseticidas é a interrupção do processo de muda dos insetos alvos, resultando em sua destruição. Como são reguladores do crescimento, são mais seletivos que os organofosforados, carbamatos e rotenóides. No entanto, também apresentam alguns efeitos prejudiciais sobre organismos aos quais não são dirigidos.
Ecdisona e Receptores da Ecdisona
O esteróide 20-hidroxiecdisona é um hormônio de desenvolvimento encontrado nos artrópodes. O processo de muda é regulado pela variação das concentrações da 20-hidroxiecdisona na larva (5). O aumento dos níveis deste hormônio leva ao início da muda. Quando a larva entra no estágio de muda, ela pára de se alimentar e o fluido de muda, que contém várias enzimas proteolíticas necessárias para a mesma, entra no espaço ecdisial. Neste ponto, as células epidérmicas entram em uma fase de aumento na síntese de proteínas (expressão do gene) e uma nova cutícula é produzida. Um decréscimo na concentração de 20-hidroxiecdisona desencadeia uma fase subseqüente, que inclui a ativação das enzimas no fluido de muda, digestão da procutícula e reabsorção do fluido de muda. Na seqüência, há mais um decréscimo na concentração de 20-hidroxiecdisona e outros hormônios, necessários para completar o processo de muda, são liberados, reiniciando-se, então, a alimentação.
O crescimento e o desenvolvimento adequado dos insetos dependem da concentração de 20-hidroxiecdisona em vários estágios de diferenciação. Sugere-se que este hormônio esteroidal esteja relacionado com a regulação da expressão genética do genoma do inseto.
Normalmente, os hormônios interagem com receptores específicos antes de iniciar um efeito fisiológico. O ecdiesteróide obriga uma proteína receptora de ecdiesteróide a regular as classes de genes “antes” e “depois” (existem numerosos exemplos deste tipo de regulação temporal nos sistemas bioquímicos. Alguns dos mais simples são encontrados em uma variedade de sistemas virais). Os genes “antes” são ativados pelo complexo hormônio/receptor. As proteínas produzidas pelos genes “antes” reprimem a transcrição destes genes, ao mesmo tempo em que ativam a transcrição dos genes “depois”. Alguns dos produtos dos genes “antes” são fatores de transcrição. Os fatores de transcrição são proteínas que podem ligar-se a curtas seqüências de nucleotídeos, resultando no início ou regulação da transcrição.
diacil-hidrazinas – inseticidas “verdes”
Algumas diacil-hidrazinas podem mimetizar o hormônio esteroidal 20-hidroxiecdisona dos insetos. As estruturas químicas da 20-hidroxiecdisona e das diacil-hidrazinas tebufenozida e da halofenozida são mostradas a seguir:
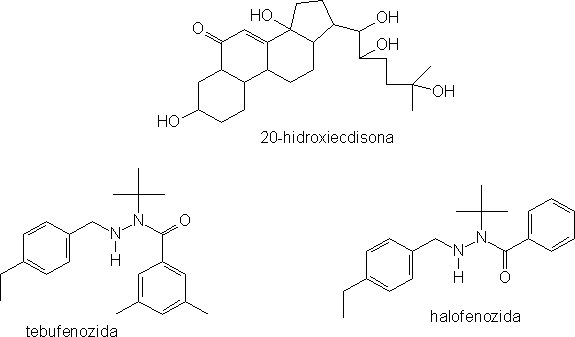
Estes inseticidas são capazes de se ligar às proteínas receptoras de ecdiesteróide. Enquanto que a expressão genética dependente da presença da 20-hidroxiecdisona ocorre na presença de diacil-hidrazinas, a expressão genética dependente da ausência da 20-hidroxiecdisona é impedida (5). O efeito tóxico das diacil-hidrazinas é devido não somente ao fato de que elas mimetizam a 20-hidroxiecdisona, mas também porque seus níveis não diminuem.
A Rohm and Haas utiliza a tebufenozida no inseticida CONFIRM. Esta diacil-hidrazina é seletiva para os insetos lepidópteros. É um pesticida altamente seletivo, com mínima toxidez para os organismos não-alvos, até mesmo para outros insetos que não são Lepidópteros. Na presença da tebufenozida, o processo de muda começa, mas na etapa do processo em que os níveis de 20-hidroxiecdisona normalmente diminuiriam, a tebufenozida permanece. O processo de muda é alterado e a alimentação não é realizada, levando à morte. A Rohm and Haas empregou a halofenozida, outra diacil-hidrazina, no inseticida MACH 2. Seu mecanismo de ação é semelhante ao da tebufenozida. Entretanto, seu alvo é diferente. Este inseticida é usado para o controle da lagarta de gramíneas.
Como mencionado anteriormente, a Rohm and Haas recebeu o Prêmio Presidential Desafio em Química Verde pelo seu trabalho com estes inseticidas e o CONFIRM foi classificado como um pesticida de risco reduzido pela EPA dos Estados Unidos.
Conclusão
Existe uma variedade de mecanismos pelos quais os inseticidas podem erradicar as populações de organismos alvos. Os inseticidas permitem um aumento na produção agrícola, sendo, portanto, fundamentais para a agroindústria. Alguns inseticidas atuam afetando processos bioquímicos que são comuns para muitos tipos de organismos. Os exemplos que nos referimos aqui, foram os inibidores da acetilcolinesterase e um inibidor da enzima encontrada na cadeia de transporte de elétrons da fosforilação oxidativa. O potencial para efeitos indesejáveis ao ambiente é maior com estes tipos de inseticida do que com aqueles que são mais específicos para um determinado alvo, tais como os aceleradores de muda.
Questões
1. Que reação química é catalisada pela acetilcolinesterase?
2. Cite duas classes de inseticidas que afetam a atividade da acetilcolinesterase. Qual o seu mecanismo de ação?
3. Comente as semelhanças e as diferenças nas formas de atuação dos inseticidas organosfosforados e carbamatos.
4. Porque é importante que a acetilcolina seja convertida rapidamente em colina e acetato?
5. Quais as conseqüências da inativação da acetilcolinesterase?
6. Descreva o papel da acetilcolina na neurotransmissão.
7. Qual o papel do fragmento serina no sítio ativo da acetilcolinesterase?
8. Como a oxidação do NADH influi no aumento da quantidade de ATP disponível para as células?
9. Qual o efeito de adicionar rotenona a um sistema onde ocorre fosforilação oxidativa?
10. Como os elétrons do NADH se movem através da cadeia de transporte de elétrons? Qual é o efeito sobre o pH da matriz mitocondrial?
11. Comente o papel da 20-hidroxiecdisona no desenvolvimento do inseto.
12. Como as diacil-hidrazinas afetam o desenvolvimento do inseto?
13. Qual é a vantagem de usar um inseticida com maior especificidade aos organismos alvos?
14. Explique porque os inseticidas organofosforados podem ser mais agudamente tóxicos do que as diacil-hidrazinas para os trabalhadores que os manipulam.
Referências
- Cann, M. C. and Connelly, M. E., Real World Cases in Green Chemistry, American Chemical Society: 2000
- Organophosphate Pesticides in Food. https://ww.epa.gov/oppsrrd1/op/primer.htm (acessada em setembro de 2004).
- Extoxnet. https://www.pmep.cce.cornell.edu/profiles/extoxnet/pyrethrins-ziram/rotenone-ext.html (accessada em setembro de 2004)
- https://wcb.ucr.edu/schools/CNAS/entm/tmiller/1/modules/page22.html (accessada em setembro de 2004)
- Dhadialla, T. S., Carlson, G. R., and Le, D. P., New Insecticides with Ecdysteroidal and Juvenile Hormone Activity. Annu. Rev. Entomol. 1998, 43, 545-569.