Inorganic Chemistry Module
Greening Across the Chemistry Curriculum English | Versión en Español  | Versão em Português (Brasil)
| Versão em Português (Brasil) 
Um Módulo de Química Verde
Uso Sugerido: Disciplina teórica de química inorgânica durante uma discussão sobre a fabricação de papel ou uma disciplina de inorgânica descrevendo agentes oxidantes ou o efeito de substituintes em reações redox de organometálicos.
Voltar para o Módulo Verde para Química Inorgânica
Ativadores Oxidantes TAMLTM: Agentes Branqueadores Verdes para a Indústria de Papel
David E. Marx, Chemistry Department, University of Scranton, Scranton, PA 18510
david.marx@scranton.edu
Histórico
Ao longo de cerca de 2000 anos a manufatura de papel vem tendo uma influência significativa no desenvolvimento da civilização. O consumo mundial de papel atualmente ultrapassa as 300 milhões de toneladas por ano,1 com um aumento considerável previsto para um futuro próximo. Estima-se que haja 10.000 fábricas de papel e papelão em operação pelo mundo. Não surpreende o fato de que o maior consumo per capta de materiais de papel está nos Estados Unidos, que ultrapassa 317 kg por pessoa a cada ano.2 Com 500 fábricas em operação, os EUA também lideram a produção de papel, produzindo cerca de 87 milhões de toneladas métricas por ano. A produção dos EUA representou mais de 1/3 da produção mundial de 1999, conforme mostrado na Figura 1. A cada ano, os EUA consomem mais de 90 milhões de toneladas métricas de papel e derivados, com a maioria sendo usada para produzir cerca de 2 bilhões de livros, 350 milhões de revistas e 24 bilhões de jornais. Em 1999, a quantidade de papel utilizado na indústria da comunicação (jornais e revistas)
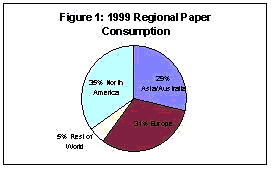 cresceu mais de 5% em relação ao ano anterior. Enquanto que o consumo de papel na indústria da comunicação aumentou, a porcentagem de papel utilizado em jornais diminuiu, caindo de 33,5% do total em 1990 para os atuais 28,9%. Durante o mesmo período, o uso para impressão e escrita sofreu um aumento de 66,5% para 71,1%, sendo que o maior aumento no consumo de papel veio de empresas comerciais que se utilizam de estratégias de marketing direto. O uso de papel cresceu marcantemente em todos os setores no último ano, incluindo impressos de escritório, copiadoras, envelopes e panfletos de propaganda. Espera-se, nesta década, um crescimento significativo no consumo de papel em países em desenvolvimento na África e na América Latina, sendo que taxas de crescimento mais acentuadas são esperadas no Sudeste Asiático. Durante os anos 90, o mercado global de papel para comunicação sofreu um aumento de 22,3% a 27,6% nos mercados da Ásia/Austrália/Fiji/Nova Zelândia. A Ásia mostrou o crescimento mais rápido, com um acréscimo de 10,0% em 1999.
cresceu mais de 5% em relação ao ano anterior. Enquanto que o consumo de papel na indústria da comunicação aumentou, a porcentagem de papel utilizado em jornais diminuiu, caindo de 33,5% do total em 1990 para os atuais 28,9%. Durante o mesmo período, o uso para impressão e escrita sofreu um aumento de 66,5% para 71,1%, sendo que o maior aumento no consumo de papel veio de empresas comerciais que se utilizam de estratégias de marketing direto. O uso de papel cresceu marcantemente em todos os setores no último ano, incluindo impressos de escritório, copiadoras, envelopes e panfletos de propaganda. Espera-se, nesta década, um crescimento significativo no consumo de papel em países em desenvolvimento na África e na América Latina, sendo que taxas de crescimento mais acentuadas são esperadas no Sudeste Asiático. Durante os anos 90, o mercado global de papel para comunicação sofreu um aumento de 22,3% a 27,6% nos mercados da Ásia/Austrália/Fiji/Nova Zelândia. A Ásia mostrou o crescimento mais rápido, com um acréscimo de 10,0% em 1999.
Obviamente, quaisquer mudanças na indústria de papel afetam enormemente a indústria química também. Apenas nos EUA e no Canadá cerca de US$ 80 bilhões são utilizados por ano para fazer torta de madeira mole branqueada. A cada dez atividades americanas, uma está relacionada ao papel. Estas atividades incluem produção, distribuição, manufatura de produtos e serviços baseados no papel, correio, impressos, publicação e embalagens. A totalidade destas indústrias combinadas representa cerca de US$ 833 bilhões de atividade econômica a cada ano.3 Por mais impressionante que sejam esses números, nós precisamos entender que o número é contrabalançado por um efetivo impacto ambiental e um dano ambiental potencial, resultantes do clareamento tradicional e de outros processos envolvidos na produção do papel.
Enquanto que o ano exato seja tema para debate, muitos estudiosos concordam que a fabricação de papel teve início na China, por volta de 200 A.C.. Esta forma de arte foi mantida em segredo por quase 1000 anos, até que o processo se espalhou pela Ásia. A fabricação de papel chegou à Inglaterra em 1494 e na América em 1690, com a construção da primeira fábrica norte-americana de papel, por William Rittenhouse, em Germantown, PA. Clique neste link para acessar o Instituto da Ciência e Tecnologia do Papel e obtenha mais informações. O método de Rittenhouse utilizou inicialmente velhos pedaços de pano em seu processo, mas eventualmente a demanda de papel ultrapassava aquela que podia ser suprida por trapos. Nos anos 1860, a indústria de papel dos EUA passou a usar madeira para a produção de papel.
A maior parte do papel nos EUA é feita das fibras naturais da madeira, chamadas celulose. Tanto madeiras duras como moles podem ser usadas no processo de fabricação do papel. As fibras de madeiras moles, como o pinus, tendem a ser duas vezes mais longas do que as fibras de madeiras duras. Como as fibras mais longas emprestam força ao papel dela obtido, as fibras de madeira mole são usadas em papéis de sacolas e caixas de mercearias. As fibras curtas produzem um papel mais regular e liso. Fibras de madeira dura, como carvalho, são misturadas com fibras mais longas para fazer papel para impressão e escrita, fortes e lisos. As madeiras duras também são mais densas do que as madeiras moles, resultando em maior quantidade de fibra por metro cúbico de madeira.
Em países onde não há abundância de árvores, pode-se utilizar outras plantas na indústria de papel. Na Índia, eucalipto, palha, algodão, kenaf e bambu servem como fonte alternativa de fibras. Uma outra importante fonte alternativa de fibra é o papel reciclado. Nos EUA, 45% do papel que é utilizado é recuperado para uso na indústria de papel, evitando a necessidade de se utilizar mais árvores no processo de produção. Entretanto, a reciclagem nunca vai eliminar a necessidade de árvores no processo de fabricação. Além da contaminação, as fibras de celulose só podem ser recicladas antes de se tornarem muito curtas e fracas para serem utilizadas. Estas fibras são removidas por lavagem no processo de formação da torta.
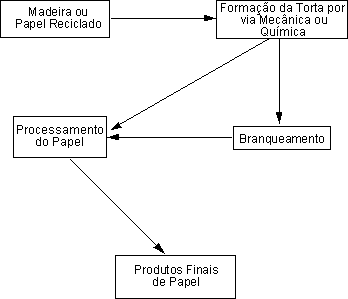
Figure 2: A General Schematic of the Paper making Process
Um diagrama esquemático do processo de fabricação do papel é mostrado na Figura 2. Na primeira etapa do processo, pedaços de madeira ou papel reciclado são quebrados em fibras individuais para fazer a chamada torta. A formação da torta pode ocorrer de duas maneiras: mecânica ou quimicamente. No processo mecânico as fibras são separadas através da trituração da madeira. Embora este processo seja muito eficiente, o papel feito de fibras “empastadas” mecanicamente tendem a ser fracos e descolorem facilmente quando expostos à luz.4 Isto ocorre devido à presença de lignina residual, o componente principal da madeira, que atua unindo as fibras de celulose umas às outras. Uma estrutura geral da lignina é mostrada na Figura 3.
Figura 3: Uma Estrutura Geral da Lignina (Reproduzida com permissão de “Real-World Cases in Green Chemistry”, direitos de reprodução em 2000 da American Chemical Society)
Na obtenção da torta por via química, os pedaços de madeira ou papel reciclado são misturados com água e produtos químicos, até que as fibras de celulose se separem. As fibras são então submetidas a um processo de branqueamento.4,5 A principal razão de se fazer o branqueamento da torta é a remoção da lignina, porque ela provoca uma descoloração no papel final, tornando-o amarronzado. A remoção da lignina, um material quimicamente complexo, produz uma torta ligeiramente escurecida. Além da celulose, a lignina e a hemicelulose também estão distribuídas pela parede celular. A composição relativa destes três componentes varia, mas em madeiras moles típicas, as proporções relativas são 28% (m/m) de lignina, 28,7% (m/m) de hemicelulose e 40,3% (m/m) de celulose, além de mais 3% de outros compostos que podem ser extraídos. Entre estes compostos se incluem gorduras e ésteres, materiais fenólicos e taninos, terpenos e resinas ácidas, os quais podem ser removidos por solventes orgânicos. Também estão presentes quantidades-traço de inorgânicos, na forma de metais pesados. No processo de obtenção da torta, a lignina é degradada em grupos cromóforos (que produzem cor), os quais podem contribuir com até 90% da cor escura característica da torta não branqueada.
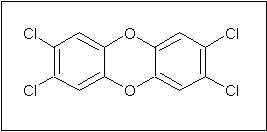
O branqueamento convencional da torta às vezes ocorre pelo Processo de Kraft. Este processo consiste de uma série de etapas de processamento químico utilizando álcali, ácido, peróxidos de hidrogênio e de sódio, oxigênio, sais ditionito, bissulfito de sódio e processos de lavagem com água, seguidos de tratamentos clorantes para remoção de qualquer lignina residual. Para realização dos tratamentos clorantes se utilizam tanto gás cloro, como sais hipoclorito e/ou dióxido de cloro. Infelizmente, embora este processo produza um papel branco brilhante, ele também causa problemas ambientais, através da produção e liberação de compostos organoclorados. Estes compostos são formados pela reação das substâncias orgânicas presentes na torta com os agentes oxidantes, que contêm cloro. A reação do cloro com a lignina produz anéis aromáticos clorados. Entre os organoclorados que são produzidos estão a 2,3,6,7-tetraclorodibenzo-4-dioxina (TCDD, também conhecida pelo nome genérico dioxina) e furanos.4,5 A TCDD é a dioxina mais comum e também a mais tóxica formada na produção de papel.6
Embora não se tenha estabelecido ainda formalmente a relação exata entre a TCDD e os riscos à saúde humana, a Agência de Proteção Ambiental Americana (EPA) observou possíveis efeitos da TCDD, especialmente cloracne, como efeitos no comportamento, alterações na aprendizagem, diminuição de hormônio sexual masculino, diabetes, toxicidade no sistema imunológico, e aumento do risco de câncer a concentrações elevadas de dioxina no corpo. A TCDD também mostrou efeito tetratogênico. A TCDD possui uma toxicidade aguda 10.000 vezes superior ao íon cianeto. Quando uma pessoa é exposta por longos períodos de tempo, podem ocorrer cirrose hepática e danos aos rins, baço, sistema nervoso central, pulmões e pâncreas. Foram observados também distúrbios na memória e concentração. Deve-se notar que a EPA declarou que, de uma maneira geral, o cidadão comum americano não se submete a uma exposição particular ao TCDD, além daquilo que ele ingere rotineiramente na comida. Estima-se que 95% da nossa exposição à dioxina ocorra através da ingestão de alimentos, principalmente através do consumo de carne vermelha, peixe e produtos enlatados. Devido à natureza apolar do TCDD, ele é muito mais solúvel no tecido adiposo dos animais do que na água. Assim, uma vez ingeridos, estes compostos tendem a se bioacumular, em vez de serem eliminados pelo corpo. Na cadeia alimentar, isto leva a concentrações maiores nas espécies superiores, um processo conhecido como bioincrementação. A sinergia entre a bioacumulação e a bioincrementação mostrou que os níveis de TCDD contaminante em peixes pode ser até 100.000 vezes superiores à contaminação nas vizinhanças nativas.7
Figura 4. Estrutura da 2,3,6,7-tetraclorodibenzo-4-dioxina
No estágio seguinte da fabricação do papel, após elaboração da torta, materiais de enchimento e aditivos especiais são combinados com a torta para dar ao papel carcterísticas especiais, tais como brilho, absortividade ou resistência à água. A mistura resultante é pulverizada a partir de um tonel, chamado tanque principal, para uma correia plástica, que se move muito rapidamente através da máquina de papel. À medida que a correia vai carregando a mistura contendo a torta, a água é eliminada e as fibras se grudam umas às outras. A teia de papel é presionada entre uma série de rolos aquecidos cobertos com feltro para fazer uma superfície lisa. Neste ponto, o papel seco é cortado em rolos ou camadas mais finos e removido da máquina de papel.
A composição química dos efluentes das fábricas de torta e papel é extremamente complexa. Para cada tonelada de torta, são produzidos aproximadamente 4 kg de cloro organicamente ligado. Foram identificados cerca de 250 compostos, sendo 180 dos quais, clorados. Várias classes de compostos clorados foram identificados, incluindo clorofenóis, catecóis, guaiacóis e siringóis. Os fenóis clorados são precursores de dibenzo-p-dioxinas policloradas (PCDDs, ou dioxinas) e dibenzofuranos (PCDFs, ou furanos). Por esta razão, os efluentes das plantas industriais de torta e papel são considerados altamente tóxicos. Um estudo realizado em plantas industriais de torta norte-americanas indicou a presença de dioxinas cloradas em concentrações de 1-51 partes por trilhão (ppt) em amostras de torta branqueada, 3,3-180 ppt no lodo primário e 3-120 partes por quatrilhão no efluente final.
Em função da preocupação com as dioxinas e com os organoclorados de uma maneira geral, a EPA baniu o uso de cloro elementar no branqueamento do papel desde abril de 2001. As estimativas atuais indicam que mais de 20% do papel branqueado do mundo seja produzido com cloro elementar. Outros 54% do papel branqueado estão sendo produzidos atualmente com dióxido de cloro, o que diminui dramaticamente a emissão de dioxina e furano, em mais de 90%.8 Este processo é chamado de ECF (abreviatura em inglês para papel Livre de Cloro Elementar, ou Elementary Chlorine Free paper). O restante do papel branqueado, uma pequena fração, é obtido utilizando métodos alternativos livres de cloro. Este processo é chamado TCF, ou Totalmente Livre de Cloro (do inglês, Totally Chlorine Free). Os produtores de papel tendem a se distanciar deste método em função de sua baixa eficiência; é necessária a utilização de cerca de 10% a mais de madeira, e além disso, o comprimento das fibras é diminuído. Como conseqüência, a reciclabilidade do papel é reduzida.
Química Verde: TAMLTM
Como resultado de trabalhos realizados nos laboratórios de Terrence Collins, da Carnegie Mellon University, foram produzidos vários ativadores de oxidação, chamados “ativadores ligantes tetraamido-macrocíclicos", abreviados como TAMLTM (do inglês, tetraamido-macrocyclic ligand activators). Por esse trabalho, Collins foi premiado com o Prêmio Presidencial Desafio em Química Verde em 1999. Estes ativadores catalisam reações de oxidação com peróxido de hidrogênio no processo de branqueamento.9 A oxidação por peróxido de hidrogênio é considerada um processo TCF, amigo do ambiente. Isto é porque apenas água e oxigênio são formados como produtos quando o peróxido de hidrogênio é consumido. Este fato está em marcante contraste com as dioxinas e furanos formados quando se utiliza cloro elementar como agente branqueador. Além do mais, estes ativadores estão livres de grupos funcionais tóxicos e não contêm elementos considerados perigosos à vida. Como um benefício adicional, o TAMLTM se mostrou eficiente mesmo à temperatura e pressão ambientes, tornando disponível para a indústria de papel o primeiro processo de delignificação por peróxido a baixa temperatura. Isto leva a uma importante economia no consumo de energia e a benefícios ambientais, como a diminuição no consumo de fontes não-renováveis (combustíveis) com a concomitante redução na produção de gases do efeito estufa.
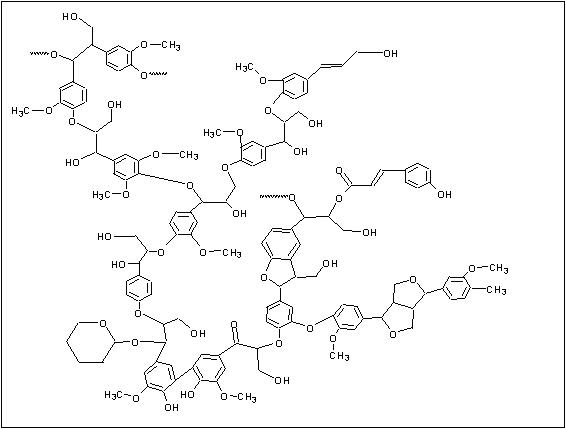
Os ativadores TAMLTM são baseados em estruturas macrocíclicas contendo ferro, como mostrado:
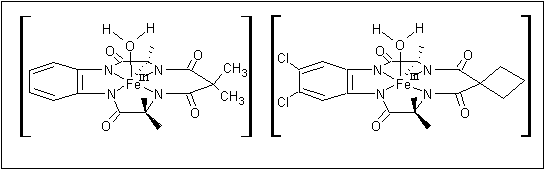
Figura 5: Ativadores TAMLTM (Reproduzido com permissão de "Real-World Cases in Green Chemistry," direitos de reprodução em 2000 da American Chemical Society)
Muitos metais mostraram-se aptos a aumentar a habilidade oxidante do peróxido de hidrogênio. O metal mais comum empregado para este propósito é o ferro. A reatividade deste tipo de sistema foi observada em 1894 por Fenton, mas a utilidade destas reações não era reconhecida até os anos 1930, quando o mecanismo foi elucidado. O reagente de Fenton é, por si só, um agente oxidante mais forte do que H2O2. Ele é capaz de oxidar di-hidrogênio e substratos orgânicos que às vezes resistem à oxidação. Ele também foi usado para iniciar reações de polimerização. A reação total é:10
2Fe2+ (aq) + H2O2 + 2H+ ![]() 2Fe3+ (aq) + 2H2O
2Fe3+ (aq) + 2H2O
Esta reação, entretanto, não explica o aumento na habilidade oxidante deste sistema. Hoje se sabe que a espécie responsável pela elevada potência oxidativa é o radical hidroxila (•OH), que se forma quando íons ferroso ou férrico interagem com o peróxido em solução aquosa, de acordo com o seguinte esquema:
Fe3+ + H2O2![]() Fe2+ + -OH + OH
Fe2+ + -OH + OH
OH + H2O2![]() HOH + HO2
HOH + HO2
HO2 + HOOH ![]() HOH + O2 + OH
HOH + O2 + OH
Fe3+ + H2O2 Fe2+ + HO2 + H+
Fe2+ + HO2 + H+
Fe3+ + HO2![]() Fe2+ + O2 + H+
Fe2+ + O2 + H+
Fe3+ + OH ![]() FeOH2+
FeOH2+
OH + S ![]() P
P
Na etapa final o substrato S é oxidado para formar o produto P.
É interessante observar que o sistema TAMLTM proposto por Collins está baseado em uma reação “Não-Fenton”. O radical hidroxila produzido em uma reação do tipo Fenton poderia ser muito reativo e acabaria atacando qualquer matéria orgânica, o que o tornaria muito indiscriminado para a oxidação seletiva. Ao invés disso, Collins propôs a formação de um intermediário reativo metal-oxo, formado pela captura de um átomo de oxigênio do peróxido de hidrogênio pelo íon metálico.11,12 Como resultado, se formaria água, juntamente com uma espécie metal-oxo oxidada em dois elétrons. Grande parte do trabalho de Collins está focalizada no desenvolvimento de ligantes multidentados que tendem a liberar elétrons e estabilizar a espécie metal-oxo. Além disso, os ligantes foram projetados para serem resistentes por períodos prolongados, de tal modo que se possa empregar um ciclo de oxidação catalítica. De outra maneira, o ligante poderia se degradar, liberando o metal central, dando seqüência a uma reação química tradicional do tipo Fenton.
Recentemente, Collins e colaboradores comunicaram que o complexo TAMLTM catalisa a oxidação de tortas com peróxido de hidrogênio. A reação foi rápida a temperaturas que variaram da ambiente até 90 ºC, e resultaram em tortas com um número de kappa reduzido de 21,5 para 7,8 em 60 minutos.13 O número de kappa se refere à quantidade de lignina que resta na polpa; dessa forma, no experimento comentado há pouco, a quantidade de lignina foi reduzida a um terço da quantidade original. Quando se adicionou agentes quelantes para remover íons metálicos contaminantes, os quais estavam decompondo prematuramente o peróxido de hidrogênio, a delignificação ocorreu mais rapidamente do que no experimento de controle. Além disso, a remoção de lignina foi maior a 50 ºC do que no controle a 90 ºC. Sob condições similares, peróxido de hidrogênio ativado pelo TAMLTM destruiu o triclorofenol, um precursor na formação da TCDD.
Os tempos de vida dos ativadores estão sob intenso estudo pelo grupo de Collins. Inicialmente, os ligantes empregados nos complexos TAMLTM duravam apenas alguns minutos até se oxidarem. Atualmente, eles sobrevivem por cerca de várias horas. Ligantes projetados para durar dias estão sendo atualmente desenvolvidos e estudados. Isto levou ao desenvolvimento de ativadores com tempos de vida ajustáveis, que podem ser escolhidos de acordo com o uso desejado. Este é, claramente, um aspecto ambiental importante.
Collins e colaboradores desenvolveram uma série de regras de proteção como um guia para o desenvolvimento de “oxidantes ativos metalo-redox” estáveis. Estes oxidantes podem oxidar um substrato sem que haja uma mudança na oxidação formal do centro metálico. Ao invés disso, o metal ativa a espécie reativa e coloca o oxidante e o substrato em um arranjo geometricamente favorável para permitir que a reação de oxidação ocorra. As quatro regras que Collins desenvolveu são:12
“I. ‘Para anéis quelados, um átomo de hidrogênio não pode estar localizado em um átomo que é b a um centro metálico oxidante, caso o átomo a possa suportar um aumento na ordem de ligação com o átomo b.’
II.‘Um heteroátomo não pode estar ligado a um anel quelado de cinco membros em um átomo que é g a um centro metálico oxidante, caso este heteroátomo possua um par de elétrons livres para estabilizar o caráter iônico incipiente no átomog quando a ligação b-g endocíclica for quebrada oxidativamente pelo metal.’
III. ‘Um heteroátomo não pode ser utilizado como um átomo doador a em um anel quelado de 5 membros, caso ele tenha um par de elétrons livres disponível para estabilizar o caráter iônico incipiente no átomo b quando a ligação b-gendocíclica for clivada oxidativamente pelo metal.’
IV. ‘Se o objetivo é produzir um oxidante fortemente transferidor de elétrons, deve-se evitar o uso de doadores N-amido como ligantes internos em ligantes quelatos acíclicos.’ ”12
Estas quatro regras fazem com que tetraamidas macrocíclicas sejam utilizadas como agentes oxidantes fortes.
A adoção da tecnologia baseada em TAMLTM, se empregada na totalidade das fábricas de papel e torta dos EUA, potencialmente poderia resultar em grande economia. Apenas a economia de energia devido à menor temperatura da água utilizada com o TAMLTM resultaria em economia de 38,9 X 1012 BTUs por ano, ou a energia equivalente a 23,15 milhões de toneladas de carvão.11 Além disso, estima-se que milhões de dólares poderiam ser economizados anualmente, dinheiro esse que de outra forma seria utilizado no controle da poluição e em equipamentos desenvolvidos para reduzir a emissão de compostos clorados gerados pelos métodos clássicos de branqueamento.
É interessante notar que, sob as definições atuais, mesmo que uma fábrica de papel utilize tecnologia baseada 100% em TAMLTM, ela ainda não pode ser considerada uma planta TCF. Isto ocorre pelo fato de que papéis reciclados são utilizados como fonte de fibra e a natureza destes papéis permanece descaracterizada. Para ser considerada uma verdadeira fábrica TCF, seria necessária a utilização de 100% de torta virgem. Isto levou várias organizações do setor industrial do papel a recomendar o uso de papel PCF (obtido por processo livre de cloro) em vez de TCF.14
A tecnologia do ativador TAMLTM é patenteada e é necessária a solicitação de pedidos de licença. Outros usos, como a aplicação em lavanderias (para reduzir o problema de transferência de corantes) estão sendo considerados. Além disso, estes complexos estão sendo indicados para utilização na purificação da água de beber9 e para uso como agente inibidor de corantes. Observou-se que os complexos oxidam moléculas de corante que foram lavadas dos tecidos pelas máquinas de lavar.9 O TAMLTM oxida essas moléculas de corantes antes que elas possam aderir a outros tecidos no ciclo de lavagem. Uma excelente apresentação de slides “on-line” feita pelo Professor Collins abordando um pouco da química descrita aqui pode ser vista clicando aqui (texto em inglês).
Questões
1. Quais são algumas das vantagens de se usar o sistema de branqueamento à base de TAMLTM/peróxido de hidrogênio sobre aquele à base de cloro?
2. Qual é a diferença entre papel PCF e TCF? (veja a Associação de Recicladores de Vermont, texto em inglês)
3. O que é um oxidante metalo-redoxiativo?
4. Que metais, além do ferro, você poderia propor para este tipo de sistema? Por quê?
5. Por quê o ligante tetraamida macrocíclico é uma boa escolha em relação a outros ligantes para esta reação?
6. Qual poderia ser o subproduto da decomposição do peróxido de hidrogênio no processo de delignificação?
7. Como os anéis aromáticos da lignina são clorados na presença de cloro gasoso? Mostre um mecanismo.
8. Que outros ligantes macrocíclicos você poderia sugerir para um estudo com relação à sua potencialidade para catalisar reações de delignificação por peróxido de hidrogênio?
9. Quando se considera apenas os átomos doadores dos ligantes tetraamida, juntamente com o ferro central e a molécula de água coordenada, como mostrado na Figura 5, qual é o grupo pontual do complexo?
10. Onde você normalmente encontra papel Kraft na sua vida? Cite alguns exemplos desde a semana passada.
Curiosidades
Você sabia que:
Considere um tronco de madeira com cerca de 2,5 m de largura, 1,2 m de espessura e 1,2 de altura; Com este tronco de madeira é possível obter, aproximadamente, um dos seguintes grupos:
7.500.000 palitos de dente?
500 a 1.000 kg de papel (dependendo do processo)?
61.370 envelopes-padrão?
4.384.000 selos?
30 cadeiras de balanço (do tipo Boston rocker)?
Bem Franklin foi o primeiro mercador de papel na América?
Nos EUA se recupera mais papel do que se joga fora?
Referências
- Para estatísticas de consumo e mercado da indústria de papel e torta nos Estados Unidos, veja: https://www.fs.fed.us/pnw/sev/rpa/ince_files/sld007.htm
- Para uma variedade de informações sobre o papel e sua fabricação, veja: https://www.tappi.org/paperu/all_about_paper/paperClips.htm
- Para um artigo de revisão excelente e de fácil entendimento, veja: "Towards Zero-Effluent Pulp and Paper Production: The Pivotal Tole of Totally Chlorine Free Bleaching," Johnston, P.A., et al., Greenpeace Research Laboratories, Technical Report 7/96, Exeter, UK, que pode ser lido e baixado em: https://xs2.greenpeace.org/~toxics/reports/tcf/tcf.html
- Weinstock, Ira A., et al., "A New Environmentally Benign Technology for Transforming Wood into Paper: Engineering Polyoxometalates as Catalysts for Mutiple Processes, J. Mol. Catal., A: Chem, 1997, 116, 59-84
- Chinier, Philip J., Survey of Industrial Chemistry, Wiley-VCH: New York, 1992
- Baird, Colin, Environmental Chemistry, 2nd ed., W. H. Freeman: New York, 1999
- Veja a página da Dioxina em: www.enviroweb.org/issues/dioxin/index.html
- Hume, Claudi, Adams, Jarret, "Weak Market Slows Migration from Chlorine," Chemweek, 1999, 17, 46-48
- Terrence J. Collins, TAML Activators: General Activation of Hydrogen Peroxide for Green Oxidation Processes, proposta submetida ao Programa Prêmio Presidencial Desafio em Química Verde, 1999
- D. Katakis and Gordan, G., Mechanisms of Inorganic Reactions, Wiley: New York, 1987, pg 6
- Collins, T. J., Gordon-Wylie, S. W., J. Amer. Chem. Soc., 1989, 111, 4511-4513
- Collins, T. J., J. Amer. Chem. Soc., 1994, 27, 9, 279-285
- Collins, T. J., et al., Development of the PFe Process: A New Catalyzed Hydrogen Peroxide Bleaching Process.,
Proceedings of the 53rd APPITA Annual Conference, APril 1999, Rotorua, New Zealand - Veja a Associação dos Recicladores de Vermont em: https://www.sover.net/~recycle/free.html