Inorganic Chemistry Module
Greening Across the Chemistry Curriculum English | Versión en Español  | Versão em Português (Brasil)
| Versão em Português (Brasil) 
Un Módulo de Química Verde
Sugerencia: Incluir en un curso de química inorgánica descriptiva durante la exposición de la fabricación de papel, o en un curso de química inorgánica avanzada en la descripción de los agentes de oxidación o el efecto de los sustituyentes sobre las reacciones redox organometálicas.
Activadores de la oxidación TAMLTM : Agentes blanqueantes "verdes" para la fabricación de papel.
David E. Marx, Chemistry Department, University of Scranton, Scranton, PA 18510
david.marx@scranton.edu
* La versión en español ha sido realizada por los profesores Dra. Mª de la Concepción F. Ling Ling y Dr. Sebastián O. Pérez Báez del Dpto. de Ingeniería de Procesos de la E.T.S.I.I., Universidad de Las Palmas de Gran Canaria, España.
Antecedentes
Durante 2000 años, la fabricación del papel ha tenido una influencia significativa en el desarrollo de la civilización. El consumo actual de papel en todo el mundo excede las 300 millones de toneladas al año,1 con una espectativa de aumento significativo en el futuro. Se estima que hay alrededor de unas 10,000 fábricas de papel y cartón operando en todo el mundo. No es sorprendente que el consumo per cápita más alto de papel corresponda a los Estados U
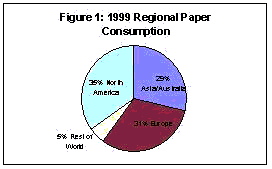
nidos, con más de 700 libras por persona al año.2 EE.UU. es también el primer productor de papel con más de 500 fábricas operando, y una producción de más de 87 millones de toneladas métricas al año. La producción de EE.UU. correspondiente al año 1999, representa más de la tercera parte de la producción mundial, tal y como muestra
la Figura 1.
Cada año se consume más de 90 millones de toneladas métricas de papel y cartón, siendo la aplicación principal la producción de unos 2 billones de libros, 350 millones de revistas y 24 billones de periódicos. En 1999, el aumento en el uso del papel en la industria de la comunicación (papel de periódico y revistas) creció más del 5% con respecto al año anterior. Mientras que el papel empleado en la industria de la comunicación ha crecido, el porcentaje de papel usado para papel de periódico h
a experimentado una disminución, cayendo del 33.5% del total en 1990 al 28.9% actual. Durante el mismo periodo, la imprenta y el material de oficina se ha visto incrementado desde un 66.5% a un 71.1%, correspondiendo el mayor aumento en el consumo de papel a las firmas comerciales que lo emplean para las estrategias de marketing directas. El uso del papel se ha intensificado en cada categoría principal durante el pasado año, incluyendo el papel para impresión y copias en oficinas, sobres y propaganda. Se espera, durante la presente década, un crecimiento significativo del consumo en países en desarrollo de Africa y America Latina, y el mayor índice de desarrollo en el Sureste Asiático. Durante la década de los 90 el mercado global de la comunicación en papel presentó un aumento del 22.3% al 27.6% en el mercado de Asia/Australia/Fiji/Nueva Zelanda. Asia registró el crecimiento más rápido con una ampliación del 10.0% en 1999.
Como es de esperar, cualquier cambio en la industria del papel, afecta de forma significativa a la industria química. Sólo en EE.UU. y Canadá, se gastaron unos 80 billones de dólares en la producción de pulpa de madera blanqueada. Uno de cada 10 puestos de trabajo en América está relacionado con el uso del papel. Estos incluyen la producción, distribución, y fabricación de productos derivados del papel, como el correo, imprenta, publicación y embalaje. La combinación total de estas industrias representan más de 833 billones de dólares de la actividad económica anual.3 Tan impresionante como es éste número, uno debe darse cuenta de que la cifra se ve compensada por el estado actual del medio ambiente y el peligro potencial sobre él como resultado del proceso tradicional de blanqueo y otros procesos implicados en la producción de papel.
Aunque se sigue discutiendo sobre el año exacto, la mayoría de los expertos están de acuerdo en que la producción de papel comenzó en China 200 a.C. Esta forma de arte se mantuvo en secreto casi 1,000 años hasta que el proceso se difundió fuera de Asia. La fabricación de papel llegó a Inglaterra en 1494, y a America en 1690, con la construcción de la primera fábrica en EE.UU. por William Rittenhouse en Germantown, PA. Click on this link para más información del Instituto de Ciencia y Tecnología del Papel. El primer método de Rittenhouse utilizaba harapos en el proceso, pero al final la demanda de papel era mayor que la disponibilidad de estos harapos. En la década de 1980, las fábricas de papel de los EE.UU. empezaron a usar la madera para la producción de papel.En EE.UU. la mayoría del papel se hace a partir de las fibras naturales de la madera llamada celulosa. Tanto la madera dura como la blanda pueden emplearse en el proceso de fabricación de papel. Las fibras procedentes de madera blanda, como el pino, tienden a ser más del doble de largas que las fibras de madera dura. Como las fibras más largas confieren una mayor resistencia del producto final del papel, las fibras de papel de madera blanda se usan en bolsas y cajas para comestibles. Las fibras más cortas tienden a hacer el papel final más suave. La fibras procedentes de la madera dura como el roble, se mezclan con fibras más largas para hacer el papel para imprenta y
escritura resistente a la vez que suave. Las maderas duras son también más densas que las blandas, dando como resultado un mayor contenido de fibra por pie cúbico de madera.
En países donde no hay abundancia de árboles, se pueden utilizar diversas plantas para la industria de fabricación de papel. En la India, el eucalipto, la paja, el algodón y el bambú sirven como alternativas de fuentes de fibras. Otra opción importante como origen de la fibra proviene del papel reciclado. En los EE.UU. un 45% del papel usado se recupera para la industria de fabricación de papel, salvando con ello la necesidad de utilizar más árboles en el proceso de producción. Sin embargo, el reciclado no elimina la necesidad de utilizar árboles en el proceso de fabricación de papel. Como adición a la contaminación, las fibras de celulosa sólo pueden ser recicladas de 5 a 7 veces antes de que se hagan demasiado cortas y débiles para ser usadas. Estas fibras se arrastran con el lavado en el proceso de obtención de pulpa.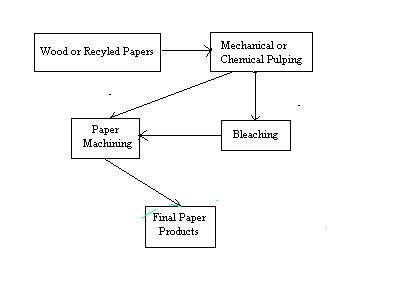
Figura 2: Esquema General del proceso de fabricación del papel
En la Figura 2 se muestra un diagrama esquemático del proceso de fabricación de papel. En el primer paso del mismo las virutas de madera o el papel reciclado se rompen en fibras individuales en un proceso llamado reducción a pulpa. Este proceso puede ser de dos tipos: mecánico o químico. En la reducción mecánica a pulpa, la fibras se separan triturando la madera. Aunque el proceso es muy eficaz, el papel obtenido a partir de el tratamiento mecánico de la fibra para obtención de pulpa, tiende a ser débil, y a decolorarse fácilmente cuando se expone a la luz.4 Ello se debe a la presencia de residuos de lignina, componente principal de la madera, que mantiene juntas las fibras de celulosa. En la Figura 3 se muestra la estructura general de la lignina.
Figura 3: Estructura generalizada de la Lignina (reproducida con permiso de "Real-World Cases in Green Chemistry," copyright 2000 de la Sociedad Americana de Química)
En la pulpa obtenida por métodos químicos, los trozos de madera o de papel reciclado se combinan con agua y productos químicos y se calientan hasta que se separan las fibras de celulosa, que a continuación se someten a un proceso de blanqueo.4,5 La principal razón del blanqueo de la pulpa es la de eliminar el contenido de lignina ya que ésta produce una decoloración marrón en el papel final. La eliminación de la lignina, que es un material químicamente complejo, produce una pulpa con un matiz más luminoso. Además de la celulosa, también se distribuyen a través de las paredes de las células, la lignina y la hemicelulosa. La proporción relativa de estos tres componentes varía, siendo la más común en las maderas blandas un 28.0%(p/p) lignina, 28.7 %(p/p) hemicelulosa, 40.3%(p/p) celulosa, y un 3% de materiales "extraíbles". Estos materiales extraíbles incluyen grasas, ésteres, materiales fenólicos y taninos, terpenos y ácidos resínicos, que pueden ser eliminados con disolventes orgánicos. Las cantidades traza de materiales inorgánicos la constituyen los metales pesados. En el proceso de obtención de pulpa, la lignina se degrada en sus grupos cromóforos (productores de color), que de otra manera causarían el 90% del color oscuro característico de la pulpa no blanqueada.
El blanqueo convencional de la pulpa se realiza mediante el proceso Kraft. Éste consiste en una serie de procesos químicos que emplean álcali, ácido, peróxido de hidrógeno y de sodio, oxígeno, sales de ditionita, bisulfito sódico y procesos de lavado con agua seguido por un tratamiento de cloración para eliminar los residuos de lignina. Los tratamientos de cloración hacen uso tanto de gas cloro como de sales de hipoclorito y/o dióxido de cloro. Por desgracia, a pesar de que este método dá lugar a un papel blanco brillante, ocasiona problemas para el medio ambiente debido a la producción y liberación de compuestos organoclorados. Estos compuestos se forman por la reacción o por los compuestos orgánicos presentes en la pulpa en contacto con los agentes clorados de oxidación. La reacción entre el cloro y la lignina dá lugar a anillos aromáticos clorados, entre los cuales se encuentran la 2,3,6,7-tetraclorodibenzo- 4-dioxina (TCDD, también conocido por el término genérico de dioxina) y los furanos.4,5 La TCDD es la dioxina más común y tóxica producida en el proceso de fabricación del papel.6
A pesar de que no han sido establecidas formalmente las relaciones entre el TCDD y los riesgos para la salud en el hombre, la Agencia de Protección Medioambiental de EE.UU. (EPA) ha notificado los posibles efectos del TCDD, como son el cloracné, trastornos de comportamiento y aprendizaje, disminución de la hormona sexual masculina, diabetes, toxicidad en el sistema inmunológico, y aumento en el riesgo de cáncer a elevadas concentraciones de dioxina en el cuerpo. La TCDD es unas 10,000 veces más agudamente tóxica que el ión cianuro. Cuando una persona se expone durante largos periodos de tiempo puede sufrir cirrosis, daños en los riñones, bazo, sistema nervisoso central, pulmones y páncreas. También se han registrado alteraciones en la memoria y capacidad de concentración. Debería considerarse que la EPA ha declarado que la media de ciudadanos americanos no presenta una exposición particular al TCDD junto con lo que habitualmente se come. Se estima que el 95% de nuestra exposición a la dioxina es a través de la ingestión de alimentos, principalmente por el consumo de carne roja, pescado y productos lácteos. Debido a la naturaleza no polar de la TCDD, al igual que muchos compuestos organoclorados, son más solubles en los tejidos grasos de los animales que en el agua. De manera que una vez ingeridos tienden a bioacumularse en el cuerpo, más que a excretarse. En la cadena alimenticia ésto dá lugar a una mayor concentración en la especies superiores, proceso conocido como bioaumento. La sinergia entre la bioacumulación y el bioaumento ha demostrado producir unos niveles de contaminación de TCDD en los peces de hasta 100,000 veces el encontrado en sus alrededores.7
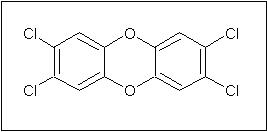
Figura 4: Estructura de la 2,3,6,7-tetraclorodibenzo-4-dioxina
En la fabricación del papel, los pasos siguientes a la obtención de pulpa, son el refinado y la aditivación, para dar al papel sus características especiales, como el brillo, la absorbancia y resistencia al agua. La lechada resultante se rocía desde una cuba, llamada tanque principal, sobre una malla plástica que se mueve rápidamente a través de la máquina de papel. Como la malla lleva la mezcla con la pulpa, el agua drena y las fibras se unen entre sí. La red de papel se presiona entre unos cilindros giratorios calentandos para hacer una superficie suave. En este punto, el papel secado se corta en rollos más estrechos u hojas, y se extrae de la máquina de papel.
La composición química de los efluentes de las fábricas de pulpa y papel que utilizan cloro elemental es sumamente compleja. Por cada tonelada de pulpa se produce aproximadamente 4 kg de cloro orgánicamente enlazado. Se han identificado más de 250 compuestos; 180 de los cuales son clorados. Se han reconocido varias clases de compuestos clorados, incluyendo clorofenoles, catecoles, guaiacoles y siringoles. Los fenoles clorados se conocen como los precursores de la dibenzo-p-dioxinas policloradas (PCDDs o dioxinas) y los dibenzofuranos (PCDFs o furanos). Por ésta razón, el efluente de las plantas de pulpa y papel se considera altamente tóxico. Un estudio realizado en las plantas de pulpa del Norte de América indica la presencia de dioxinas cloradas en muestras de pulpa blanqueada con una concentración de 1-51 partes por trillón (ppt), de 3.3-180ppt en el sedimento primario, y de 3-120 partes por cuatrillón en el efluente final.
Como resultado en lo referente a las dioxinas, y a los compuestos organoclorados en general, la EPA ha prohibido el uso de cloro elemental en el blanqueo del papel desde abril de 2001. Las valoraciones actuales indican que a nivel mundial se produce hasta un 20% del papel blanqueado con cloro elemental. Otro 54% del papel blanqueado se produce actualmente con dióxido de cloro, reduciendo significativamente las emisiones de dioxina y furano a > 90%.8 A este proceso se le llama ECF, o Papel Libre de Cloro Elemental. El resto del papel blanqueado, una pequeña fracción, se produce usando alternativas libres de cloro, a este proceso se le llama TCF, o Totalmente Libre de Cloro. Los fabricantes de papel suelen negarse a utilizar este último método debido a su baja eficacia; ya que se necesita usar un 10% más de madera, y la longitud de la fibra es menor, de manera que disminuye la posibilidad de reciclar el papel.
QUÍMICA VERDE: TAMLTM
El trabajo desarrollado en los laboratorios deTerrence Collins de la Universidad de Carnegie Mellon ha elaborado una serie de activadores de la oxidación llamados "ligandos tetraamido-macrocíclicos activadores", o de forma abreviada TAML.TM Por este trabajo, Collins recibió el premio Presidential Green Chemistry Challenge Award en 1999. Estos activadores catalizan las reacciones de oxidación del peróxido de hidrógeno en el proceso de blanqueo del papel.9 La oxidación con peróxido de hidrógeno se considera como un proceso TCF, beneficioso para el medio ambiente. Ello se debe a que los productos formados, cuando se utiliza peróxido de hidrógeno, son sólo agua y oxígeno, lo cual contrasta marcadamente con las dioxinas y furanos que se producen cuando se emplea cloro elemental como agente blanqueante. Más aún, estos activadores están libres de grupos funcionales tóxicos y no contienen elementos que se consideren peligrosos para la vida. Otra ventaja adicional es que el TAMLTM ha demostrados ser efectivo a temperatura y presión ambientes, proveyendo a la industria del papel del primer proceso de deslignificación con peróxido a abaja temperatura. Esto conduce a un ahorro significativo de los costes energéticos y a beneficios para el medio ambiente tales como la reducción en el consumo de fuentes no renovables (fuel) y en la producción de gases invernadero.
Los activadores TAMLTM se basan en estructuras macrocíclicas de hierro como se muestra en la figura:
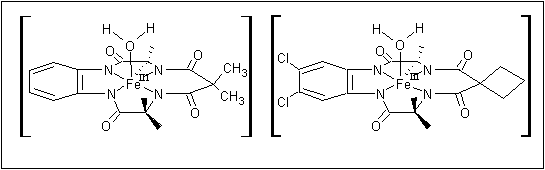
Figura 5: Activadores TAMLTM (reproducido con permiso de "Real-World Cases in Green Chemistry," copyright 2000 de la Sociedad Americana de Química)
Muchos metales presentan la habilidad de mejorar la capacidad oxidante del peróxido de hidrógeno. El metal más comunmente empleado con este propósito es el hierro. La reactividad de este tipo de sistemas fue observada en 1894 por Fenton, pero la utilidad de estas reacciones no se reconoció hasta 1930, cuando quedó claro el mecanismo. El reactivo de Fenton es un agente oxidante más fuerte que el H2O2 . Es capaz de oxidar el dihidrógeno y sustratos orgánicos que se resisten a la oxidación. También se ha empleado para iniciar reacciones de polimerización. La reacción completa es:10
2Fe2+ (aq) + H2O2 + 2H+ ![]() 2Fe3+ (aq) + 2H2O
2Fe3+ (aq) + 2H2O
Sin embargo, esta reacción no explica el aumento en la capacidad oxidante del sistema. Actualmente se sabe que la especie responsable del aumento del poder oxidante es el radical (.OH) altamente reactitvo, el cual se forma cuando el ión ferroso o férrico interactúa con el peróxido en solución acuosa, de acuerdo con el siguiente esquema:
Fe3+ + H2O2![]() Fe2+ + -OH + OH
Fe2+ + -OH + OH
OH + H2O2![]() HOH + HO2
HOH + HO2
HO2 + HOOH ![]() HOH + O2 + OH
HOH + O2 + OH
Fe3+ + H2O2![]() Fe2+ + HO2 + H+
Fe2+ + HO2 + H+
Fe3+ + HO2![]() Fe2+ + O2 + H+
Fe2+ + O2 + H+
Fe3+ + OH ![]() FeOH2+
FeOH2+
OH + S ![]() P
P
En el paso final, el sustrato S se oxida para formar el producto P.
Es interesante hacer notar que el sistema TAMLTM propuesto por Collins opera como una reacción no basada en Fenton. El radical hidroxil producido en una reacción tipo Fenton debería ser altamente reactivo y tendería a limpiar cualquier materia orgánica, haciéndolo demasiado imperceptible para una oxidación selectiva. En vez de esto, Collins ha propuesto la formación de un intermedio reactivo metal-oxo formado a partir de la sustracción de un átomo de oxígeno del peróxido de hidrógeno por el ión metálico.11, 12 Como resultado podría formarse agua junto con dos especies metal-oxo electrón oxidadas. La mayor parte del trabajo de Collins se centra en el diseño de ligandos multidentados que tienden a liberar electrones y estabilizar las especies metal-oxo. Además los ligandos han sido diseñados para ser resistentes a la oxidación durante largos periodos con el fin de catalizar el ciclo de oxidación para el que se emplean. De otra manera, el ligando se degradaría, liberándose el centro metálico y siguiéndose una reacción química del tipo Fenton.
Collins et al. han publicado recientemente que el complejo TAMLTM cataliza la oxidación de las pulpas por el peróxido de hidrógeno. La reacción tiene lugar rápidamente en un rango de temperaturas desde la ambiental hasta los 90 oC, dando como resultado en las pulpas una reducción del número kappa desde 21.5 a 7.8 en 60 minutos.13 El número kappa se refiere a la cantidad de lignina liberada de la pulpa, de manera que en el experimento que se lleva a cabo la lignina se reduce a la tercera parte de su cantidad original. Cuando se añaden agentes quelantes, para eliminar los iones metálicos contaminantes que descomponen prematuramente el peróxido de hidrógeno, la deslignificación procede más rápidamente que en el experimento controlado. Además la eliminación de lignina fue mayor a 50 oC que a la temperatura de control de 90 oC. Bajo condiciones similares, el peróxido de hidrógeno activado por el TAMLTM destruye el triclorofenol, precursor de la formación de TCDD.
El grupo de Collins ha realizado un estudio más profundo acerca del tiempo de vida del activador, ya que los ligandos empleados en el complejo de TAMLTM duraban sólo unos minutos antes de ser oxidados. Actualmente permanecen durante horas. Los últimos ligandos diseñados se encuentran bajo estudio. Esto ha conducido a desarrollar el ajuste de los tiempos de vida del activador, para permitir la elección en función de su aplicación, lo que es claramente una característica importante para el medio ambiente.
Collins, et al. han expuesto una serie de reglas de protección de los ligandos como guía para el diseño de "oxidantes metaloredox-activos" estables.
Estos oxidantes oxidarán al sustrato sin necesidad de ir acompañados por un cambio de oxidación esencial del centro metálico. En vez de ello, el metal activa las especies reactivas y colocan al oxidante y al sustrato en una disposición geométricamente favorable para permitir que la reacción de oxidación tenga lugar. Las cuatro reglas que Collins ha desarrollado son12:
"I. 'Para anillos quelados, el átomo de hidrógeno no se colocará sobre un átomo en posición beta del centro metálico oxidante, si el átomo-alpha puede soportar un aumento en el orden de enlace con el átomo- beta.'
II. 'No se ligará un heteroátomo a un anillo quelado de 5 componentes sobre un átomo que es gamma con respecto al centro metálico oxidante, si el heteroátomo tiene un par aislado disponible que estabilice la formación del carácter catiónico sobre el átomo gamma cuando el enlace endocíclico beta-gamma se adhiere por el metal mediante oxidación.'
III. 'No se empleará a un heteroátomo como un átomo donador alpha en un anillo quelado de cinco componentes, si éste tiene un par aislado disponible para estabilizar la formación del carácter catiónico sobre el átomo beta cuando el enlace endocíclico beta-gamma se adhiere por el metal mediante oxidación.'
IV. 'Si la finalidad es producir un oxidante fuerte por transferencia de electrones, se evitarán los donantes amido-N como ligandos internos en ligandos quelados acíclicos.' "12
Estas cuatro reglas conducen al empleo de las tetraamidas macrocíclicas como fuertes agentes oxidantes.
La adopción de la tecnología basada en el TAMLTM tiene el potencial de dar como resultado un ahorro significativo si se emplea en un 100% en el tratamiento de la fabricación de pulpa y papel en los EE.UU. Sólo el ahorro de energía debido al uso de bajas temperaturas del agua con el TAMLTM supondría un ahorro de 38.9 x 1012 BTU al año, o la energía equivalente de 23.15 milliones de toneladas de carbón.11 Se estima que además podrían ahorrarse billones de dólares en los gastos para la reducción de la contaminación y en el equipo diseñado para reducir la emisión de los compuestos organoclorados formados por los métodos tradicionales de blanqueo.
Es interesante hacer notar que bajo las presentes descripciones, una planta que emplease al 100% la tecnología basada en el TAMLTM no podría aún considerárse como una planta TCF . Ello se debe a que el papel reciclado es empleado como fuente de fibra y la naturaleza de estos papeles siguen sin estar caracterizadas. Para poder estimarla realmente como una planta TCF debería emplearse pulpa virgen al 100% . Ello conduce a que varias organizaciones de fabricación de papel recomienden el uso del papel PCF (Procesado Libre del Cloro) frente al papel TCF .14
La tecnología del activador TAMLTM está patentada y han sido publicados los acuerdos de licencia para su comercialización. Se han considerado otras aplicaciones, como las de las lavanderías (para reducir el problema de transferencia de tinte). Además se ha propuesto el uso de estos complejos para la purificación del agua potable,9 y para el uso como agente de inhibición del tinte. Estos complejos han demostrados oxidar las moléculas de tinte liberadas durante el enjuage de los tejidos en las lavadoras.9 El TAMLTM oxida éstas moléculas de tinte antes de que tengan la oportunidad de adherirse a otros tejidos en el ciclo de lavado. Una excelente presentación en diapositiva on-line descrita por el Professor Collins, que nos lleva a parte de la química aquí expuesta, puede verse pinchando aquí clicking here.Cuestiones
1. ¿Cuáles son algunas de las ventajas del uso del TAMLTM/sistema de blanqueo con peróxido de hidrógeno frente a otros sistemas clorados?
2. ¿Cuál es la diferencia entre el papel PCF y el TCF ? (ver la Association of Vermont Recyclers)
3. ¿Qué es un oxidante metalo-redox activo?
4. ¿Qué otros metales propone en vez del hierro en este tipo de sistema? ¿Por qué?
5. ¿Por qué el ligando tetraamida macrocíclico es una buena elección frente a otros ligandos para esta reacción?
6. ¿Cuál sería el subproducto de descomposición del peróxido de hidrógeno en el proceso de deslignificación?
7. ¿Cómo se cloran los anillos aromáticos de la lignina en presencia del gas cloro? Muestre un mecanismo.
8. ¿Qué otros ligando macrocíclicos sugiere por su potencial para catalizar las reacciones de deslignificación con el peróxido de hidrógeno?
9. Cuando consideramos sólo los átomos donadores de los ligandos tetraamida, junto con el átomo central de hierro y la molécula de agua coordinada, como se muestra en la figua 5, ¿cuál es el grupo punto del complejo?
10. ¿Dónde se encuentra normalmente con el papel Kraft a diario? Cite algunos ejemplos de la última semana.
Curiosidades
Sabía usted que:
1 tronco de leña tiene las dimensiones de 8 pies de ancho por 4 de fondo y 4 de alto? A partir de él podríamos obtener aproximadamente los siguientes grupos de productos:
7,500,000 palillos de dientes
1000-2000 libras de papel (dependiendo del proceso)
61,370 sobres estándar
4,384,000 sellos
30 Boston rockers
Ben Franklin fue el primer comerciante de papel en America?
En EE.UU. se recupera más papel del que se entierra al año?
Referencias Bibliográficas
1. See https://www.fs.fed.us/pnw/sev/rpa/ince_files/sld007.htm for consumption and monetary statistics of the paper and pulp
industry in the US.
2. See https://www.tappi.org/paperu/all_about_paper/paperClips.htmfor a variety of information about paper and paper
making.
3. For an excellent comprehensive review, see "Towards Zero-Effluent Pulp and Paper Production: The Pivotal Tole of
Totally Chlorine Free Bleaching," Johnston, P.A., et al., Greenpeace Research Laboratories, Technical Report 7/96,
Exeter, UK which can be viewed and downloaded at: https://xs2.greenpeace.org/~toxics/reports/tcf/tcf.html
4. Weinstock, Ira A., et al., "A New Environmentally Benign Technology for Transforming Wood into Paper: Engineering
Polyoxometalates as Catalysts for Mutiple Processes, J. Mol. Catal., A: Chem, 1997, 116, 59-84
5. Chinier, Philip J., Survey of Industrial Chemistry, Wiley-VCH: New York, 1992
6. Baird, Colin, Environmental Chemistry, 2nd ed., W. H. Freeman: New York, 1999
7. See Dioxin Homepage at: www.enviroweb.org/issues/dioxin/index.html
8. Hume, Claudi, Adams, Jarret, "Weak Market Slows Migration from Chlorine," Chemweek, 1999, 17, 46-48
9. Terrence J. Collins, TAML Activators: General Activation of Hydrogen Peroxide for Green Oxidation Processes, a
proposal submitted to the Presidential Green Chemistry Challenge Awards Program, 1999
10. D. Katakis and Gordan, G., Mechanisms of Inorganic Reactions, Wiley: New York, 1987, pg 6
11. Collins, T. J., Gordon-Wylie, S. W., J. Amer. Chem. Soc., 1989, 111, 4511-4513
12. Collins, T. J., J. Amer. Chem. Soc., 1994, 27, 9, 279-285
13. Collins, T. J., et al., Development of the PFe Process: A New Catalyzed Hydrogen Peroxide Bleaching Process.,
Proceedings of the 53rd APPITA Annual Conference, APril 1999, Rotorua, New Zealand
14. See the Association of Vermont Recyclers at: https://www.sover.net/~recycle/free.html
