General Module
Greening Across the Chemistry Curriculum English | Versión en Español  | Versão em Português (Brasil)
| Versão em Português (Brasil) 
Um Módulo de Química Verde
Uso Sugerido: Disciplina de química geral, durante discussões de diagrama de fases, fluidos supercríticos e polaridade de moléculas.
Donna Narsavage-Heald, Chemistry Department, University of Scranton
Compostos orgânicos voláteis (VOCs) e compostos orgânicos halogenados são utilizados largamente em vários tipos de limpeza. Alguns exemplos dos usos industriais destes solventes são:
- remoção por fluxo
- remoção de óleos e graxas de partes de metal
- limpeza de vestuários
Adicionalmente, o consumidor individual usa muitos produtos domésticos que contêm VOCs e compostos orgânicos halogenados, como por exemplo:
- corantes e vernizes
- tíner (solvente) para uso em tintas
- removedor de esmaltes de unhas
- adesivos
- lustra-móveis
- spray para cabelos
Estima-se que o uso mundial de VOCs e compostos orgânicos halogenados seja superior a 13,6 milhões de toneladas por ano! Muitos destes solventes constituem uma ameaça para qualidade do nosso ar, suprimentos de água, camada de ozônio, e à saúde pessoal. Vamos explorar agora alguns exemplos destes solventes, para que eles são utilizados e os efeitos que causam no nosso ambiente.
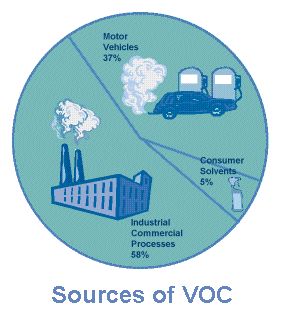
Compostos Orgânicos Voláteis (VOCs)Figura 1. Fontes de VOCs (retirada da página da epa)
Os VOCs incluem solventes como o xileno, benzeno, tolueno, cloreto de metileno e álcool isopropílico. Eles são largamente utilizados na indústria porque são relativamente baratos, apolares e, conseqüentemente, efetivos para dissolverem óleos, ceras e graxas. Além disso, o consumidor comum usa muitos VOCs no seu dia-a-dia. VOCs também estão presentes na gasolina, tintas, colas, vernizes e produtos de limpeza doméstica. Os VOCs também são liberados na queima de combustíveis (gasolina, óleo, carvão vegetal, gás natural, etc.) e os automóveis são uma fonte importante de VOCs.
Estes compostos são chamados de compostos orgânicos voláteis porque apresentam uma pressão de vapor elevada, e muitos deles evaporam rapidamente à temperatura ambiente. Esta grande pressão de vapor é geralmente devida às fracas forças intermoleculares entre estas moléculas apolares. Por causa desta volatilidade os VOCs podem ser utilizados para limpeza de itens delicados, como componentes eletrônicos ou um casaco de lã, sem a necessidade do uso de aquecimento para evaporar o solvente. Também graças a esta volatilidade, eles podem facilmente evaporar para a atmosfera e diminuir a qualidade do ar.
VOCs reagem com óxidos de nitrogênio na presença de luz solar para formar o ozônio (O3) e outros poluentes (Esquema 1). O ozônio é o principal componente da “smog” fotoquímica e da poluição de muitas cidades do mundo. Poluentes adicionais, que são produzidos pela interação da luz do sol com VOCs e óxidos de nitrogênio, incluem o acido nítrico, que leva à chuva ácida, aldeídos, cetonas e outros compostos resultantes da oxidação parcial dos VOCs.
Figura 2. Atmosfera da Terra (retirada da página da epa)

Apesar de ser grande o interesse atual sobre o esgotamento da camada de ozônio estratosférica (Figura 2), a produção de ozônio na troposfera, ao contrário, acarreta um risco significativo à saúde. A troposfera inclui a atmosfera em que vivemos e é muito preocupante a presença de ozônio no ar que respiramos. Exposições freqüentes ao ozônio podem resultar em danos permanentes aos pulmões, dor no peito, congestão e náuseas. O ozônio troposférico também causa danos à vida das plantas e as torna mais suscetíveis a insetos, doenças e outros poluentes. Clique aqui para saber mais sobre os níveis de ozônio nos EUA.
Compostos orgânicos halogenados são compostos à base de carbono que possuem um halogênio, como flúor, cloro e bromo. Duas das maiores classes de compostos orgânicos halogenados são os clorofluorocarbonetos (CFC) e os hidroclorofluorocarbonetos (HCFC).
Em geral, estes compostos são muito pouco reativos, não são tóxicos e nem inflamáveis. Estas propriedades contribuíram para o uso de CFC e HCFC como solventes para limpeza industrial. Além disso, estas substâncias são largamente utilizadas como gases refrigerantes, propelentes para aerossóis e agentes espumantes (para fazer bolhas). Os nomes e fórmulas de alguns dos mais comuns CFCs e HCFCs estão mostrados na tabela abaixo:
triclorofluorometano |
monoclorodifluorometano |
diclorodifluorometano |
diclorotrifluoretano |
Apesar dos CFCs possuírem propriedades que os tornam excelentes solventes e úteis em muitas aplicações, sabe-se agora que eles se decompõem rapidamente na estratosfera, sob a influência da radiação UV de alta energia (UV-C). Estes produtos de decomposição catalisam reações que destroem a camada de ozônio estratosférica, resultando em um aumento significativo na intensidade da radiação UV prejudicial que atinge a superfície do planeta Terra. Em vista disto, e com base na Lei do Ar Limpo de 1990, os CFCs não podem mais ser produzidos ou importados pelos Estados Unidos da América. Os HCFCs estão sendo utilizados temporariamente como substitutos dos CFCs, porque os HCFCs não possuem grande potencial de degradação da camada de ozônio. A ligação carbono-hidrogênio nos HCFCs faz com que estes sejam muito mais reativos que os CFCs e a maioria das moléculas de HCFC são destruídas na troposfera. Isto evita que a maior parte do HCFC suba até a estratosfera, onde ele também poderia agir na destruição da camada de ozônio.
Dióxido de Carbono: Um Solvente Alternativo que é Ambientalmente Preferível do que os VOCs e os Compostos Orgânicos Halogenados
Devido aos muitos efeitos negativos causados ao ambiente pelos VOCs e solventes halogenados, é importante que se encontre alternativas a estes solventes. O dióxido de carbono apresenta-se como uma alternativa para VOCs e compostos orgânicos halogenados e oferece muitas vantagens ao ser utilizado como solvente. O dióxido de carbono não é inflamável, não é tóxico, é quimicamente inerte e, além disso, é obtido por um preço baixo como um subproduto recuperado da produção de amônia e em poços de gás natural.1 Além disso, o dióxido de carbono utilizado pode facilmente ser recuperado, purificado e reutilizado.
Diferentemente dos CFCs e HCFCs, o dióxido de carbono não contribui para a degradação da camada de ozônio e, ao contrário dos VOCs, o dióxido de carbono não participa na formação do ozônio troposférico. Entretanto, o dióxido de carbono traz outros efeitos negativos ao ambiente. Como o dióxido de carbono na atmosfera reflete a radiação infravermelha (calor) de volta para a Terra, ele é um gás estufa, e desta maneira contribui para o aquecimento global. Para que o CO2 possa ser considerado uma alternativa verde para os VOCs e os solventes orgânicos halogenados, o CO2 utilizado precisa ser reciclado. Após o dióxido de carbono ser utilizado como solvente, ele pode ser recuperado e reutilizado, simplesmente permitindo que o dióxido de carbono líquido ou super-crítico seja convertido a gás, capturando o dióxido de carbono gasoso e deixando as impurezas menos voláteis para trás. Este processo de reciclagem requer muito pouca energia, visto que o CO2 existe como um gás sob condições ambientes. Comparado com solventes orgânicos ou com a água, sua entalpia de vaporização é consideravelmente menor.
Uma outra consideração que precisa ser feita quando se pensa no dióxido de carbono como substituto para solventes menos benignos ao ambiente, é a fonte de CO2. Como indicado anteriormente, o dióxido de carbono é obtido como um produto residual na produção de amônia e em poços de gás natural e pode ser recuperado destes processos. Desta maneira, não é necessária a produção de dióxido de carbono adicional, e o dióxido de carbono que poderia normalmente ser liberado na atmosfera por esses processos, pode na verdade ser capturado e utilizado de uma forma benéfica. Muitos destes fatores contribuem para que o dióxido de carbono seja uma alternativa verde para os VOCs e solventes orgânicos halogenados.
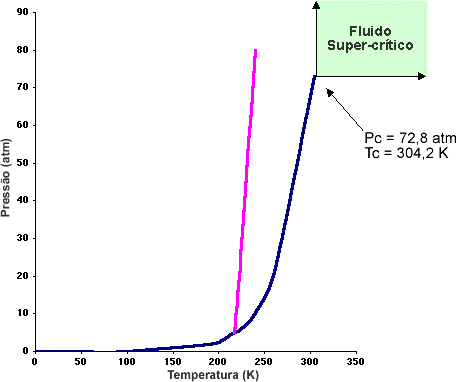
Conforme indicamos acima, o dióxido de carbono é um gás à temperatura ambiente e à pressão atmosférica. Para que o CO2 possa ser utilizado como solvente, ele deve ser convertido para um estado super-crítico ou estado líquido. Conforme mostrado no diagrama de fases que segue, o dióxido de carbono possui uma temperatura super-crítica (Tc) de 31 °C e uma pressão super-crítica de 72,8 atm. Fluidos supercríticos possuem propriedades de ambos, gás e líquido. CO2 super-crítico é utilizado atualmente para descafeinar o café “naturalmente”.
Apesar de o dióxido de carbono possuir ligações polares, ele é uma molécula apolar, visto que os dipolos das duas ligações se cancelam.
Devido à sua natureza apolar, o dióxido de carbono dissolve pequenas moléculas apolares, como hidrocarbonetos contendo menos de 20 átomos de carbono e outras moléculas orgânicas como aldeídos, ésteres, e cetonas,2 porém não irá dissolver moléculas grandes como óleos, ceras, graxas, polímeros, proteínas ou moléculas polares. Entretanto, utilizando um surfactante, a solubilidade de muitas substâncias em CO2 pode ser aumentada.
Surfactantes são substâncias que aumentam a solubilidade de uma substância em outra. Sabões e detergentes são surfactantes comuns, que possibilitam que substâncias não polares, como óleo e graxa se emulsifiquem, e sejam lavados (removidos) com um solvente polar, a água. A partir de nossa experiência do dia-a-dia, sabemos que água e óleo não se misturam, isto é, que eles são insolúveis um no outro. Eles são insolúveis um no outro porque o óleo é apolar e a água é polar, e como diz a lei da solubilidade: “semelhante dissolve semelhante”. Em outras palavras, solventes polares dissolvem solutos polares e solventes apolares dissolvem solutos apolares. Um surfactante é uma molécula que contém uma porção polar e outra porção apolar. Tendo grupos polares e apolares na mesma molécula, um surfactante pode interagir tanto com moléculas polares como apolares, aumentando dessa maneira a solubilidade de duas substâncias que antes eram insolúveis.
Em água, moléculas de surfactantes tendem a agrupar-se com uma geometria esférica com as extremidades apolares do lado de dentro da esfera e as e a extremidades polares no lado de fora. A extremidade polar está do lado de fora, podendo assim interagir com o solvente polar, a água. Estes agrupamentos são chamados de micelas e é mostrado um exemplo na Figura 4.
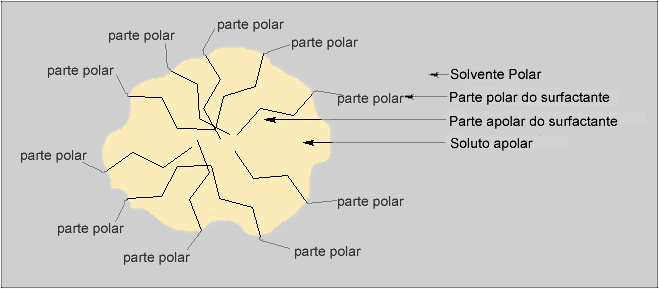
(reproduzido com permissão da American Chemical Society)
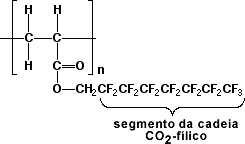
Um surfactante para o CO2 líquido ou fluido super-crítico deverá possuir tanto funcionalidade CO2-fílica (que gosta de CO2) como CO2-fóbica. Em 1994, Joseph M. DeSimone, da Universidade da Carolina do Norte e da Universidade Estadual da Carolina do Norte, publicou sua descoberta, de que polímeros como o que é mostrado na Figura 5 são solúveis em CO2 super-crítico ou CO2 líquido.3 Este fluoropolímero é solúvel em CO2 devido às fracas interações de van der Walls que estão presentes entre o CO2 e a cauda de fluorocarbono do polímero.
Polímeros são moléculas com massas molares muito grandes. A água possui massa molar 18 uma, mas muitos polímeros possuem geralmente massas molares que vão de 10.000 até alguns milhões de uma. O poliestireno é um polímero muito comum, com a seguinte unidade que repete:
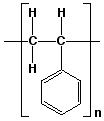
Isto significa que a unidade contida entre os colchetes se repete inúmeras vezes. Mais especificamente, ela se repete n vezes, e nós poderíamos chamar n de grau de polimerização. Para muitos polímeros, n > 10.000.
O poliestireno é utilizado para uma variedade de aplicações em embalagens, como copos plásticos para bebidas, tampas, embalagens para produtos pequenos, como amoras ou tomates cereja. Como espuma, é popularmente conhecido como estiro-espuma e é utilizado como copo para bebidas quentes, espuma isolante e nos familiares “amendoins” utilizados para o transporte de itens delicados.
O poliestireno é um polímero quebradiço e muitas vezes é combinado com outros políremos para melhorar suas propriedades. Uma maneira para modificar as propriedades de um polímero é fazer um copolímero. Um copolímero contém dois tipos diferentes de unidades que se repetem dentro da mesma cadeia polimérica. Um copolímero não é uma mistura de dois políremos diferentes; em vez disso, os dois monômeros são ligados covalentemente ao longo da cadeia. Um copolímero de estireno e acrilonitrila é utilizado na fabricação de peças de automóvel, utensílios (prateleiras de refrigeradores), suprimentos médicos e caixas de baterias.
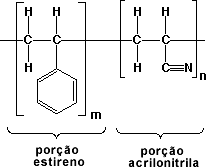
Figura 7. Copolímero Estireno Acrilonitrila
Os copolímeros podem existir em uma variedade de arranjos diferentes. Três seqüências possíveis no arranjo de copolíremos são mostradas abaixo. Nestas estruturas, E representa monômeros de estireno e A representa monômeros de acrilonitrila.
Aleatórios EAEAEAAEEAEEAE
Blocos EEEEEEAAAAAAAA
Alternados EAEAEAEAEAEAEA
O polímero mostrado na Figura 5 é pouco comum porque a maioria dos políremos não é solúvel em CO2. Na verdade, o polímero da Figura 5 é um dos dois únicos políremos de alta massa molecular solúveis em CO2.4 Então, para fazer um surfactante para o CO2, DeSimone sintetizou copolímeros utilizando o poliestireno como a porção CO2-fóbica, e o polímero mostrado na Figura 5 como a porção CO2-fílica.2 A Figura 8 mostra a estrutura deste copolímero de blocos. O copolímero mostrado na Figura 8 pode ser representado esquematicamente como EEEEEEEEAAAAAAA, onde E= unidades de estireno e A= unidades de fluoroacrilatos.
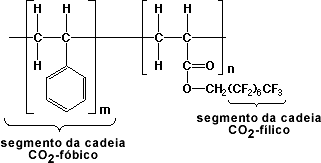
Figura 8. Copolímero contendo Unidades CO2-fóbica e CO2 -fílica
Assim como os surfactantes para a água formam estruturas micelares, o mesmo também acontece para os surfactantes de CO2. A Figura 9 mostra esta estrutura de micela para um surfactante de CO2, com a porção CO2-fílica do lado externo da micela. Da mesma forma que um detergente age como surfactante para limpeza utilizando a água como solvente, um surfactante de CO2 pode aumentar a solubilidade de graxas, ceras e óleos no solvente CO2.
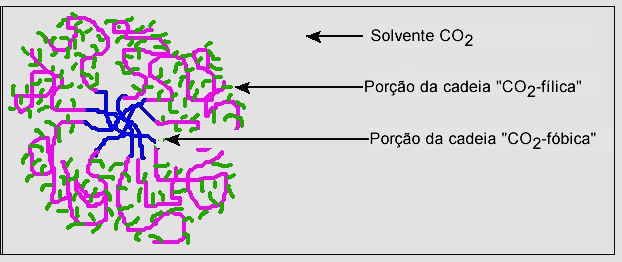
(reproduzido com permissão da American Chemical Society)
Uso Atual de Surfactantes para o CO2– Química Verde em AÇÃO
A indústria da lavagem a seco utiliza em geral o solvente percloroetileno (PERC) como agente de limpeza. Como as roupas são limpas com uma solução de limpeza constituída principalmente por PERC, e muita pouca quantidade de água é usada, o termo “lavagem a seco” é utilizado.
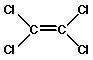
Estima-se que 155 mil toneladas de PERC foram produzidas nos Estados Unidos em 1998. A indústria da lavagem a seco utiliza aproximadamente 50% do PERC produzido durante o ano, o que chega a cerca de 77 mil toneladas do solvente. A EPA classificou o PERC como contaminante de lençóis freáticos e de risco potencial para a saúde humana. O PERC é suspeito de ser carcinogênico para o homem, e um conhecido carcinógeno para os roedores. Respirar PERC por curtos períodos de tempo pode afetar de maneira adversa o sistema nervoso central. Seus efeitos incluem tonturas, fadigas, dores de cabeça, transpirações, perda de coordenação e pode causar inconsciência. Estes efeitos não são observados nos níveis de PERC encontrados no ambiente, entretanto as pessoas que trabalham em lavagem a seco nas indústrias correm o maior risco, devido à exposição.
O uso de PERC na indústria da lavagem a seco teve início na década de 1930. Anteriormente ao PERC, produtos derivados do petróleo, tais como a querosene, eram os solventes para lavagem a seco utilizados, mas devido à sua alta inflamabilidade, era perigoso trabalhar com eles e a ocorrência de incêndios era comum. O PERC, entretanto, não é inflamável e oferece vantagens significativas sobre os agentes de limpeza à base de petróleo. Devido à dupla ligação presente no PERC, ele é destruído na troposfera, evitando que ele suba até a estratosfera. Desta forma, ao contrário de muitos outros compostos orgânicos halogenados, o PERC não contribui para a destruição da camada de ozônio. Entretanto, o PERC pode contribuir para formação da névoa fotoquímica (smog), quando ele reage com outros VOCs, óxido de nitrogênio e com a luz do sol (Esquema 1).
Micell Technologies, uma empresa fundada em 1995 por Joseph DeSimone, Timothy Romack e James McClain, produz a tecnologia de surfactantes para CO2 disponível comercialmente. O sistema Micareô, da Micell é uma máquina de lavar comercial que utiliza CO2 e surfactante para o CO2 ao invés de PERC, eliminando assim a necessidade do hidrocarboneto clorado PERC. A franquia de lavanderia americana Hangersutiliza esta tecnologia.
A Micell Technologies também desenvolveu a tecnologia conhecida como sistema Micleanô para remoção de óleos e graxas de componentes metálicos, eliminando assim a necessidade de se utilizar solventes halogenados para limpeza.
O Professor DeSimone ganhou um Prêmio Presidencial Desafio em Química Verde em 1997, pela descoberta e desenvolvimento de surfactantes para o dióxido de carbono. Ele também recebeu os prêmios Governor’s Award for Excellence, o National Science Foundation's Young Investigator Award e o Presidential Faculty Fellow Award. Ele e a Micell Technologies também receberam o R&D 100 Award, quando o Micareô foi considerado um dos “100 novos produtos e processos tecnologicamente mais importantes do ano”.

Referências
1. DeSimone, Joseph M. Design and Application of Surfactants for Carbon Dioxide, proposta submetida ao Prêmio Presidencial Desafio em Química Verde, 1997.
2. Hyatt, John A. Liquid and Supercritical Carbon Dioxide as Organic Solvents. J. Am. Chem. Soc. 1986, 49, 5097-5101.
3. Guan, Zhibin; DeSimone, J.M. Fluorocarbon-Based Heterophase Polymeric Materials. J. Am. Chem. Soc. 1994, 27, 5527-5532.
4. DeSimone, J.M.; Maury, E,E.; Menceloglu, Y.Z.; McClain, J.B.; Romack, T.J.; Combes, J.R. Dispersion Polymerizations in Supercritical Carbon Dioxide. Science, 1996, 271, 624-626.