Advenced Organic Modules
Greening Across the Chemistry Curriculum English | Versión en Español  | Versão em Português (Brasil)
| Versão em Português (Brasil) 
Um Módulo de Química Verde
Uso Sugerido: Disciplina de química orgânica avançada durante uma discussão sobre reações de substituição nucleofílica ou reações de substituição aromática.
Substituição Nucleofílica Aromática: Um pouco da nova química verde para uma velha reação
Trudy A. Dickneider, Ph.D., Department of Chemistry, University of Scranton
Introdução
Moléculas de benzeno substituídas têm grande importância em aplicações químicas industriais. Normalmente elas são utilizadas como solventes e às vezes são intermediários importantes em muitas sínteses, incluindo aquelas de poderosos agentes farmacêuticos. Uma classe de compostos obtidos desta maneira serve como intermediários na síntese de compostos antidegradantes que são muito importantes na indústria de borracha sintética. Este módulo trata de um método recentemente desenvolvido para a produção de um destes intermediários, a 4-amino-difenilamina (4-ADPA). A química apresentada exemplifica uma abordagem inovadora para o problema de introdução de um nucleófilo em sistemas com anel aromático de uma forma que reduz bastante os problemas ambientais negativos associados com os procedimentos sintéticos mais conhecidos. O método mais comum para produzir anéis benzênicos substituídos envolve a bem conhecida reação de substituição eletrofílica aromática (SEA). Esta reação permite a fácil substituição de hidrogênio por grupos nitro, halogênios, ácido sulfônico, grupos alquila e acila. Enquanto que as aplicações desta reação para substituições múltiplas são limitadas pelas propriedades orto/para ou meta dirigentes dos grupos no anel, bem como com suas propriedades ativante/desativante, normalmente é possível preparar o composto desejado, desde que o grupo a ser introduzido no anel seja um eletrófilo. Isto significa que uma família inteira de substituintes, que são de natureza nucleofílica, não pode ser introduzida no anel por SEA. Em geral, reações envolvendo a substituição de nucleóficlos são difíceis. Sob as condições ideais para reações de substituição nucleofílica elas produzem quantidades desprezíveis do produto. Se recordarmos os dois mecanismos para a substituição nucleofílica, SN1 e SN2, verifica-se a razão: com um anel aromático não há possibildiade de ataque por trás no carbono, o hidrogênio é um grupo abandonador muito ruim, e o sistema aromático não vai se ionizar facilmente pela perda do hidrogênio. Desta forma, para que se possa introduzir importantes nucleófilos ao anel é preciso aplicar alguns truques ao anel. Sob as condições especiais resultantes destes artifícios, é possível incorporar nucleófilos ao anel. É esta reação, a Substituição Nucleofílica Aromática (SNA) que é o tópico deste módulo. Nós iremos abordar a química tradicional para a SNA, juntamente com os mecanismos elucidados. Ao fazermos isso, veremos que esta química possui vários problemas ambientais que a tornam indesejável como um processo industrial em larga escala. Em resposta a estes problemas, a Flexsys America L.P.(1) desenvolveu um método para eliminar estes problemas na produção do importante intermediário, 4-amino-difenilamina. Em reconhecimento ao seu trabalho, eles foram agraciados com o Prêmio Presidencial Desafio em Química Verde. Nós examinaremos o mecanismo e as condições desta reação e faremos especulações sobre sua adaptabilidade para sínteses posteriores.
O MecanismoExistem pelo menos quatro mecanismos(2), atuando sob diferentes condições, para a introdução de um nucleófilo em um anel aromático. São eles os mecanismos SNAr, Benzino, SN1, e SN2. Embora estes quatro tenham sido identificados e estudados, a maioria das reações de substituição nucleofílica que são normalmente realizadas ocorrem ou via mecanismo SNAr ou Benzino e assim nós iremos nos concentrar nestes e consideraremos apenas brevemente os outros dois.
Mecanismo SNAr [adição/eliminação]Este é o mecanismo mais importante para as reações de substituição nucleofílica aromática. A evidência experimental indica que há duas etapas e assim ele às vezes é chamado de mecanismo de adição/eliminação. A reação começa com o ataque donucleófilo ao carbono contendo o grupo abandonador. Esta é a etapa de adição da reação. Isto produz um intermediário aniônico. Este íon, conhecido como complexo de Meisenheimer, é estabilizado por ressonância.
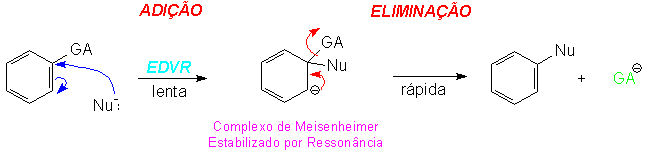
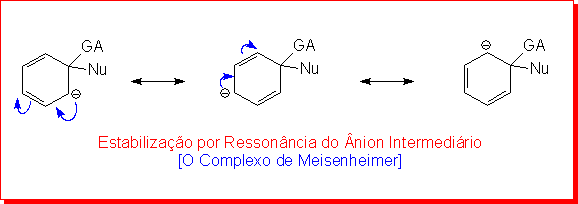
Na Segunda etapa da reação, a eliminação ocorre quando o anel sofre rearomatização com a perda do Grupo Abandonador. A primeira etapa, na qual o anel perde sua estabilização aromática e o ânion é produzido é a etapa lenta ou Etapa Determinante da Velocidade da Reação (EDVR).
Entretanto, a reação da forma como está mostrada acima não deveria ocorrer para formar o produto! A estabilização por ressonância sozinha não é suficiente para formar o intermediário aniônico. Ele precisa ser estabilizado por grupos fortemente retirantes de elétrons em posições orto e/ou para ao grupo abandonador.
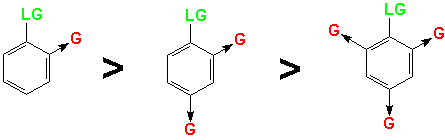

Os mecanismos são, obviamente, baseados em evidência experimental. Há várias observações importantes e resultados que dão suporte ao mecanismo SNAr. O mais importante destes é o isolamento do intermediário, a peça de evidência mais persuasiva para qualquer mecanismo!
A reação mostrada abaixo produz um sal estável que foi isolado e caracterizado. Ele foi isolado pela primeira vez por Jacob Meinsenheimer,(3) que foi quem propôs a estrutura correta, a qual foi confirmada mais tarde por estudos de RMN.
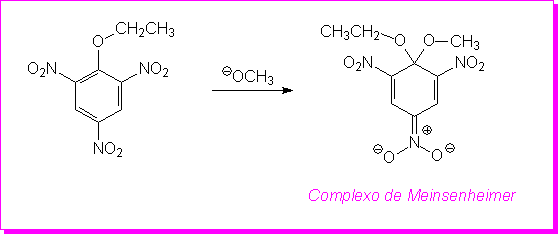
Um suporte adicional para o mecanismo SNAr vem do fato de que a natureza do Grupo Abandonador tem pouco efeito no curso da reação. Como todos os grupos abandonadores aniônicos, o GA na SNA parte com um par de elétrons e, dessa forma, ele precisa ser uma espécie que esteja apta a carregar uma carga negativa. Entretanto, como são observados apenas efeitos pequenos quando se varia o GA ao se comparar espécies as quais podem formar ânions estáveis, isto poderia indicar que a ligação do Grupo Abandonador não é quebrada na etapa determinante da velocidade da reação. Isto dá respaldo ao mecanismo de duas etapas SNAr. Para os halogênios, que são os grupos de saída mais comuns em reações SNA, sua reatividade paralela com a eletronegatividade (F >>Cl, Br, I), porque quanto mais eletronegativo o átomo, mais densidade eletrônica ele retira do carbono. Quanto mais positivo o carbono, mais rápido ele irá sofrer o ataque pelo nucleófilo.
Esta reação encontrou grande utilidade sintética, entretanto, ela produz um produto com os grupos ativantes retirantes de elétrons ligados ao anel! Quando a reação SNA é parte de um esquema sintético de múltiplas etapas isto pode ou não ser desejável. Portanto, reações SNA que se baseiam apenas neste mecanismo nem sempre levarão à síntese de todos os produtos desejados.
O Mecanismo do Benzino [eliminação/adição]
Um anel benzênico contendo um bom grupo abandonador pode sofrer Substituição Nucleofílica Aromática mesmo sem a presença de grupos fortemente retirantes de elétrons na(s) posição(ões) orto/para. Para que isto ocorra, o substrato aromático precisa ser tratado com uma base forte o bastante para abstrair um próton. Quando a Base/Nucleófilo retira o hidrogênio, os elétrons sigma que ligam o hidrogênio ao carbono são doados ao carbono contendo o grupo abandonador, causando a saída do grupo abandonador. Isto produz um intermediário único, BENZINO. Este intermediário então reage com o ácido conjugado da Base/Nucleófilo, ao qual o nucleófilo se adiciona, deixando novamente o anel em seu estado aromático original.
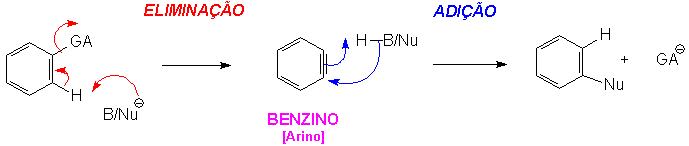
O resultado final é que nesta reação a ordem do processo é invertida em comparação com o mecanismo SNAr; o substrato benzênico sofre uma reação de eliminação – perda de H e GA – seguida por uma adição do nucleófilo.
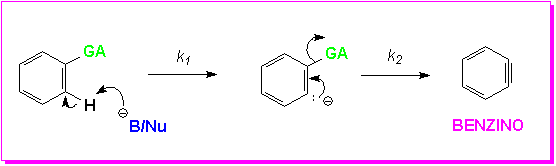
Há um forte suporte experimental para o Mecanismo do Benzino. A primeira peça de evidência reside na habilidade do grupo abandonador. Para os halogênios, novamente o mais importante grupo abandonador, a ordem (Br > I > Cl >> F) desvia significativamente daquela verificada no mecanismo SNAr.(4) Isto indica que um mecanismo diferente está atuando.
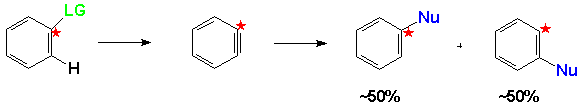
A identidade do grupo abandonador também afeta a etapa que é determinante da velocidade, outra peça de evidência para sustentação. Para entender isto é necessário olharmos de perto para a etapa de Eliminação deste mecanismo. Esta etapa pode ser concertada (como sugerido acima) ou ela pode ser passo a passo (veja abaixo).

Todavia, a evidência mais convincente para este mecanismo pode estar associada com o próprio intermediário Benzino. Apesar dele nunca ter sido isolado sob condições experimentais, ele foi estudado em argônio a 8 K e seu espectro foi feito durante o progresso das reações.(6)
A densidade eletrônica disponibilizada pela “tripla ligação” o torna um pseudo dienófilo em reações de Diels-Alder. Quando o Benzino é gerado através da diazotação do ácido antranílico na presença de um Dieno, como o furano, um aduto de Diels-Alder é recuperado da mistura reacional.(7)
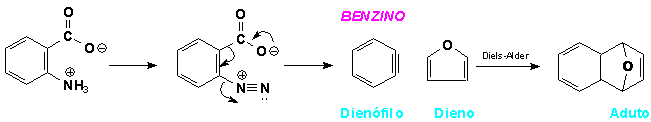
Esta captura do intermediário Benzino é uma forte evidência que dá suporte à sua existência.
Outros MecanismosHá dois outros mecanismos possíveis para a substituição nucleofílica aromática. Cada um deles refere-se a substratos específicos e, portanto, não são rotas comuns a anéis aromáticos substituídos com espécies nucleofílicas. Desta forma, nós iremos examiná-los apenas brevemente, concentrando-nos na reação e alguma evidência para cada rota proposta.
Mecanismo SN1Este é um mecanismo comum para a substituição de sais de diazônio por nucleófilos. Neste caso, o grupo abandonador não é um haleto ou sulfonato, como em muitas reações SNA, mas sim uma molécula de nitrogênio perdida pelo sal de diazônio.
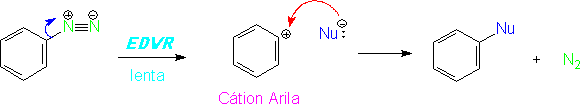
A evidência mais importante da ocorrência deste mecanismo de reação vem de estudos cinéticos, que indicam que a reação é de primeira ordem para o sal de diazônio, sendo a etapa lenta da reação a decomposição do sal. Como o nucleófilo não está envolvido na EDVR, a reação é, na verdade, uma reação SN1 para a substituição aromática.
Mecanismo SNR1Há evidências experimentais que indicam que certos substratos aromáticos, particularmente iodobenzenos, sofrem reações de substituição nucleofílica por um mecanismo de radical livre. O mecanismo proposto para esta reação começa com uma etapa de iniciação, na qual um elétron é transferido ao substrato aromático por um doador de elétrons, formando um radical-ânion. Esta espécie perde iodeto na primeira etapa de propagação, para dar um radical arila. O nucleófilo reage com o radical arila para dar um outro radical arila na segunda etapa de propagação da cadeia. Na terceira etapa da cadeia este radical perde um elétron para uma outra molécula do substrato, levando ao produto de substituição nucleofílica e outro radical-ânion, estabelecendo assim a cadeia que é característica das reações via radical livre. As etapas de propagação da cadeia são seguidas de várias etapas de terminação, incluindo combinações de radicais formados nas etapas de propagação ou a reação de um radical aromático com um doador de hidrogênio para produzir benzeno.
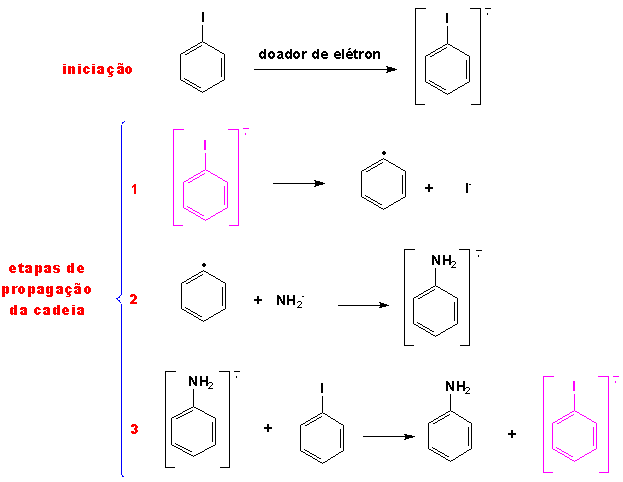
O mecanismo SNR1 mostrou-se muito versátil, porque não há a necessidade de grupos ativantes como substituinte no anel para que a reação ocorra. A reação pode ser iniciada eletroquimicamente ou fotoliticamente e susbtratos contendo os outros halogênios, bem como metilamina quaternária, também irão sofrer reação pelo mecanismo de radical livre na presença de um doador de elétrons para iniciar a reação.
Química Verde - Uma rota sintética alternativa para a Substituição Nucleofílica AromáticaPrêmio Desafio em Química Verde - Eliminação do Cloro na Síntese da 4-aminodifenilamina: Um Novo Processo que Utiliza a Substituição Nucleofílica Aromática do Hidrogênio
 Introdução
Introdução
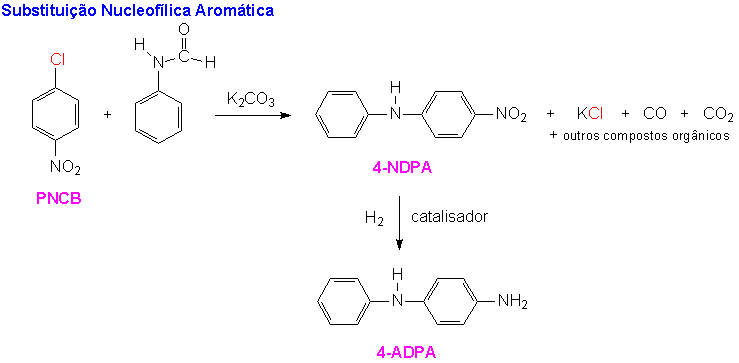
A indústria química da borracha utiliza várias classes de compostos como antidegradantes. Eles são antioxidantes e antiozonantes. Estes compostos desempenham uma função importante, porque eles protegem a borracha, natural ou sintética, dos efeitos danosos da exposição à atmosfera e à luz do sol. Os tipos de compostos orgânicos utilizados como antidegradantes são mostrados à esquerda. Os antioxidantes retardam a oxidação da borracha. Eles reagem com hidroperóxidos e produzem compostos que não reagem com a borracha. Como se acredita que a borracha fica quebradiça em função de um processo oxidativo que acelera qualquer ruptura mecânica, eles também agem como "antifissuras" e evitam que a borracha fique trincada. Alguns também são classificados como agentes antifadiga. Os antiozonantes também são utilizados em combinação com as borrachas insaturadas, para evitar reação com o ozônio da atmosfera, que provoca fissuras na superfície do composto de borracha. Embora o mecanismo de ação dos antiozonantes não seja conhecido, eles aparentemente funcionam como um filme que cobre a superfície da borracha. Um dos intermediários mais importantes na síntese destes antidegradantes é a 4-aminodifenilamina (4-ADPA).
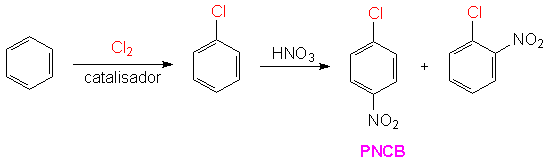
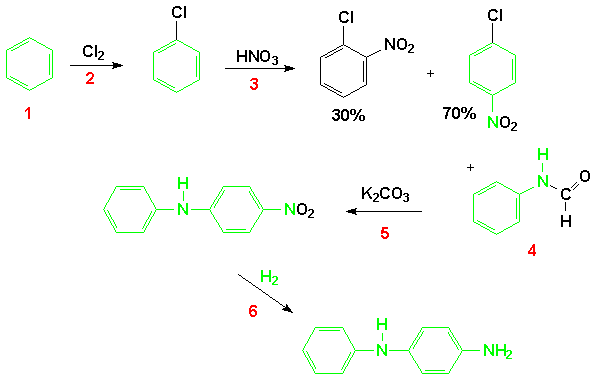
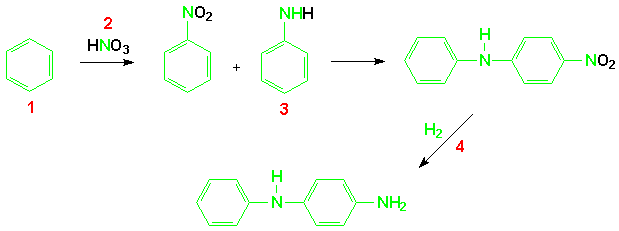
O Método Industrial ExistenteA preparação industrial atual do 4-ADPA usa duas reações de substituição eletrofílica aromática para preparar o anel para a substituição nucleofílica aromática. A primeira, a cloração do benzeno, fornece o grupo abandonador. A segunda, nitração do clorobenzeno, serve para ativar a molécula para a reação de substituição nucleofílica aromática necessária para adicionar formanilida ao substrato. A hidrogenação do composto difenil nitrato fornece a 4-aminodifenilamina desejada. A seqüência começa com uma reação de substituição eletrofílica aromática (SEAr) bem conhecida, na qual o átomo de cloro substitui o de hidrogênio no núcleo benzeno. Uma outra reação SEAr nitra o composto nas posições orto e para. Esta regiosseletividade é resultante da natureza dirigente do cloro presente no substrato. É a doação de elétrons por ressonância que estabiliza a espécie do estado de transição, levando ao íon benzenônio intermediário para os produtos orto e para. Relembrando, embora os halogênios sejam doadores de elétrons por ressonância, eles são retirantes de elétrons por indução e o efeito indutivo é mais forte que o efeito de ressonância. Portanto, esta reação deveria acontecer a uma velocidade menor do que a nitração do benzeno não-substituído. Estas reações SEAr são mostradas abaixo.
Economia de Átomos da Reação
Tradicionalmente, os químicos têm medido a eficiência de uma reação pela determinação do rendimento em porcentagem (rendimento %) da reação. Entretanto, o rendimento % refere-se apenas à quantidade do(s) produtos(s) isolado(s) (relativa ao reagente limitante) e não considera a eficiência da reação relativa aos subprodutos (resíduos) que são formados. O conceito de Economia de Átomos (desenvolvido por Barry Trost estende a consideração da eficiência de uma reação levando em conta todos os átomos nos reagentes e quanto deles são incorporados ou utilizados no produto desejado ou quanto deles acabaram (inutilizados) em subprodutos. É possível calcular a % de Economia de Átomos determinando a massa de todos os átomos que são utilizados no produto desejado, dividindo esta massa pela massa total de todos os átomos dos reagentes e multiplicando por 100. Para uma discussão mais completa, veja o Módulo Verde para Química Orgânica: “ECONOMIA DE ÁTOMOS: Uma Medida da Eficiência de uma Reação”
Um exame das reações acima demonstra vários problemas de economia de átomos. A primeira SEAr utiliza dois átomos de cloro, e nenhum deles é incorporado ao produto final.
O esquema total para a preparação tradicional do 4-ADPA é mostrado abaixo. Os substratos e reagentes estão marcados em vermelho.
|
Fórmula do reagente
|
PF do reagente
|
Átomos utilizados
|
Peso
|
Átomos não utilizado
|
Peso |
|
1 C6H6
|
6 C, 4 H
|
2 H
|
|||
|
2Cl2
|
------------
|
2 Cl
|
|||
|
3 HNO3
|
1 N
|
1 H, 3 O
|
|||
|
4 C7H7NO
|
6 C, 6 H, 1 N
|
1 C, 1 O, 1 H
|
|||
|
5 K2CO3
|
------------
|
2 K, 1 C, 3 O
|
|||
|
6 H2
|
2 H
|
--------------
|
|||
TOTAL |
12C, 12H, 2N
|
2C,4H,2Cl,2K,7O
|
A Economia de Átomos da reação é igual ao peso dos átomos utilizados dividido pelo peso de todos os reagentes usados.
% de Economia de Átomos = 161/432 x 100 = 37%Este cálculo demonstra claramente os problemas associados com a química atual.
Química Marrom da Reação AtualAlém da economia de átomos desfavorável e os resultantes impactos ambiental e econômico, as reações atualmente utilizadas para preparar 4-ADPA apresentam várias outras preocupações ambientais. A primeira é o rendimento em % do para-cloronitrobenzeno, de apenas 70%, com os outros 30% sendo o subptoduto indesejado, orto-cloronitrobenzeno. A segunda é o uso de um outro hidrocarboneto aromático, o xileno, como solvente para a reação de SNA. Este material precisa ser descartado de maneira adequada como um resíduo químico tóxico que apresenta um perigo potencial ao ambiente, o que representa um custo adicional à produção do 4-ADPA. Entretanto, as maiores preocupações com esta rota reacional estão centradas em dois aspectos. O primeiro, e mais importante, é que grandes quantidades de gás cloro são utilizadas na primeira etapa da reação. Este gás precisa ser armazenado e manuseado apropriadamente para minimizar o risco de escape para a atmosfera, onde ele poderia provocar graves conseqüências ambientais e à saúde. Além disso, ele é um composto da lista da SARA (Lei norte-americana do Superfundo de Emendas e Reautorizações) e a quantidade de cloro armazenado e utilizado precisa ser informada à EPA anualmente. Plantas industriais que utilizam materiais da SARA precisam também elaborar um plano de materiais perigosos, demosntrando seu planejamento para lidar com situações de vazamento e acidentes com o composto. A segunda preocupação é com a quantidade e variedade de resíduos produzidos nesta seqüência reacional. A rota total produz uma solução aquosa de sais inorgânicos. O problema é que este efluente residual aquoso pode estar contaminado com os materiais orgânicos que são os substratos e produtos das etapas envolvidas nesta seqüência reacional, pois todos são polares o bastante para ter alguma solubilidade em água. Embora não seja, certamente, impossível separar os resíduos desta reação, este processo consome tempo, é caro e representa mais riscos de contaminação do ambiente. A natureza desta química é demonstrada pelo fato de que a Monsanto Chemical Company considerou esta como uma das reações “que mais geram resíduos e potencialmente perigosas” que ela desenvolve nas suas várias plantas industriais em operação!(9)
É claro que a solução foi desenvolver uma reação que poderia fornecer o 4-ADPA sem a utilização de um material de partida clorado. A Alternativa da Química Verde

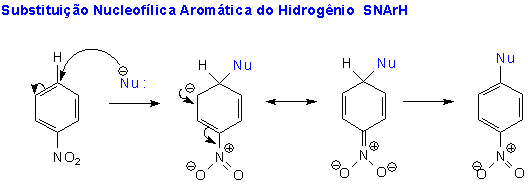
Os químicos da pesquisa e desenvolvimento da Monsanto concluíram que a solução para estes problemas ambientais envolvia a substituição da SNA tradicional por uma que envolvesse a substituição do hidrogênio, eliminando, portanto, a necessidade do substrato clorado. Existem vários exemplos desta substituição nucleofílica aromática do hidrogênio (SNArH) descritos na literatura. A nova química foi desenvolvida pela Flexys America.
A Rota Reacional Alternativa
A reação geral para uma substituição nucleofílica do hidrogênio é mostrada abaixo.
A aplicação desta reação na síntese do 4-ADPA foi desenvolvida graças ao trabalho de Sterns, Hileman e Bashkin.(10) A nova química envolve o acoplamento da anilina com o nitrobenzeno em uma reação de substituição do hidrogênio. Este tipo de reação foi descrito na literatura pela primeira vez em 1903 e ocorre com um rendimento de 50%.
Na verdade, todas as reações de SNArH da literatura sofrem das mesmas limitações. Como um grupo, elas ocorrem com baixo rendimento e seletividade. Embora a reação possa ser utilizada para produzir compostos em pequena escala no laboratório para fins de pesquisa, estes problemas tornam esta reação inviável para aplicação industrial na preparação de grandes quantidades de material.
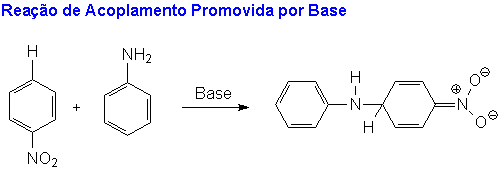
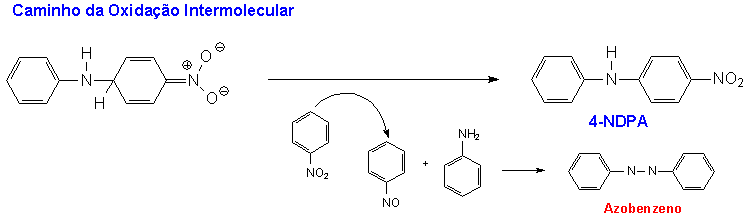
A reação proposta pelos químicos da Monsanto usa uma base para produzir um melhor nucleófilo. A base retira um próton da anilina para produzir um íon anilida, que é um nucleófilo muito mais poderoso. A primeira etapa da reação é então uma reação de acoplamento promovida por uma base, na qual o grupo anilida ataca o carbono para ao grupo nitro ativante.
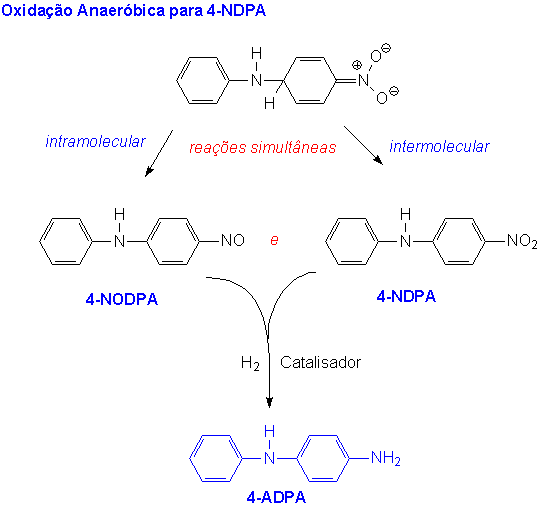
Um cálculo similar da Economia de Átomos da reação de SNArH da Flexys é baseado na reação total mostrada abaixo.
|
Fórmula do reagente
|
PF do reagente
|
Átomos utilizados |
Peso
|
Átomos não utilizados
|
Peso
|
|
1 C6H6
|
78
|
6 C, 4 H
|
76
|
2 H
|
2
|
|
2 HNO3
|
63
|
1 N
|
14
|
1 H, 3 O
|
49
|
|
3 C6H7N
|
93
|
6 C, 6 H, N
|
92
|
1 H
|
1
|
|
4 H2
|
2
|
2 H
|
2
|
-----------
|
0
|
TOTAL |
236
|
12C,12H,2N
|
184
|
4H,3O
|
52
|
A Economia de Átomos da SNArH da Flexys é dada por
% de Economia de Átomos = 184/236 x 100 = 78%e representa um incremento de duas vezes sobre a química tradicional!
Química Verde na SNArH da FlexysEsta seqüência reacional alternativa possui muitas vantagens ambientais significativas em relação à rota tradicional. A empresa descreve cinco vantagens ambientais importantes do novo processo.(12) São elas:
- Grande redução de resíduo orgânico na reação industrial. Os químicos da Flexys comunicaram que a nova reação reduz o resíduo orgânico em cerca de 74% e elimina 99% do resíduo inorgânico. Na inscrição para o Prêmio Desafio em Química Verde, a Flexys diz que se apenas 30% da demanda mundial de 4-ADPA fosse produzida pela SNArH, estaria sendo evitada a formação de 34,5 mil toneladas de resíduos.
- Redução da água residual formada em mais de 97%. Se a química da Flexys fosse usada para obtenção de 30% de todo o 4-ADPA obtido anualmente, ela poderia economizar cerca de 630 milhões de litros de água por ano.
- Eliminação do uso de cloro, um reagente perigoso e difícil de manipular.
- Eliminação do uso de xileno, que é o solvente necessário na química tradicional. O xileno, que é um hidrocarboneto aromático possui uma série de problemas de manuseio, armazenamento e descarte.
- Aumento na segurança industrial. Comparada com a química tradicional para produção de 4-ADPA, a nova química não se utiliza de uma série de processos contínuos e altas temperaturas, que podem - e devem levar, a reações fora do controle. A Monsanto cita este como sendo um de seus processo sintéticos mais perigosos e que reações fora de controle já foram experienciadas por eles em 1979, que resultaram na explosão de um reator. A nova química não mostra qualquer potencial para condições fora de controle.
Questões para Estudo
1. Escreva as estruturas de ressonância que contribuem de forma importante para o complexo de Meisenheimer para a reação de SNAr para os seguintes substratos.
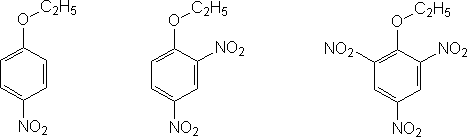
2. Com base nas estruturas que você desenhou na questão 1, qual composto você poderia predizer como sendo o melhor substrato para uma substituição nucleofílica aromática pelo mecanismo SNAr? Explique claramente sua resposta.
3. Os químicos da Flexys estenderam sua química de SNArH para a sínte de aminas a partir da reação do nitrobenzeno com amidas. Faça uma busca na literatura e encontre uma referência para uma reação deste tipo. Compare o mecanismo proposto para esta reação àquele proposto para a produção do 4-ADPA.
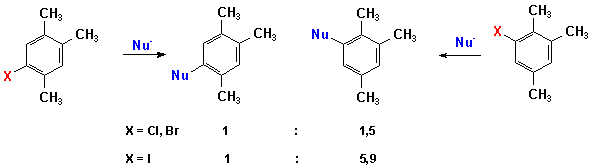
4. Escreva um mecanismo do Benzino para reação do 5-cloro e do 6-cloro-1,2,4-trimetilbenzeno com amida mostrando a origem dos produtos 5 e 6-substituídos a partir de cada substrato, explicando a relação observada entre os produtos.
5. Qual método experimental você poderia utilizar para determinar se uma reação de substituição nucleofílica aromática ocorreu por um mecanismo SNAr ou do Benzino?
6. Desenvolva uma seqüência reacional que poderia converter azobenzeno em anilina.
7. O produto da síntese da Flexys, 4-ADPA, é um intermediário importante na síntese de antidegradantes utilizados na composição de borrachas. Um desses antidegradantes, que serve como composto antiozonante e antifissuras, é a N-isopropil-N’-fenil-p-fenilenodiamina. Proponha uma rota sintética razoável para este composto utilizando 4-ADPA.
Sugestões para mais estudo
1. Utilizando um programa de modelagem molecular, construa um modelo do benzino, mostrando a localização da densidade dos elétrons no intemediário.
Referências
11.Stern, M. K. and Cheng, B., J. Org. Chem., 58, 6883 (1993).
12.Rains, op. cit.