Green Chemistry
Greening Across the Chemistry Curriculum English | Versión en Español  | Versão em Português (Brasil)
| Versão em Português (Brasil) 
Un Módulo de QuímicaVerde
Sugerencia: Incluir en un curso de Química Orgánica (tanto en clase como en el laboratorio) durante la impartición de diversas reacciones (sustitución, eliminación, adición, reordenamiento, etc.)
ATOM ECONOMY: A Measure of the Efficiency of a Reaction
Michael C. Cann, Chemistry Department, University of Scranton
michael.cann@scranton.edu
LA ECONOMÍA DEL ÁTOMO: Medida de la eficacia de una reacción.
Eficacia de una reacción
Rendimiento
Aunque la eficacia de una reacción puede medirse de muchas maneras, la más común es la de calcular el rendimiento (en porcentaje). Con frecuencia, los estudiantes tienen que calcular, especialmente en el laboratorio, el rendimiento teórico basado en el reactivo limitante, y después calcular el rendimiento porcentual a partir de la relación entre el rendimiento real/rendimiento teórico y multiplicarlo por 100. En general, los químicos orgánicos consideran que un rendimiento del 90% o superior es excelente, mientras que un 20% o inferior es pobre.
Rendimiento teórico = (moles de reactivo limitante)(relación estequiométrica; producto deseado/reactivo limitante)(MM del producto deseado)
Renndimiento Porcentual = (rendimiento real/rendimiento teórico) X 100
Con el fin de ilustrar el cálculo del rendimiento porcentual (y la medida de la eficacia de una reacción ), consideremos la siguiente reacción de sustitución nucleófila, en medio ácido. Un método habitual1 para ésta reacción comienza con la disolución
Ecuación 1a
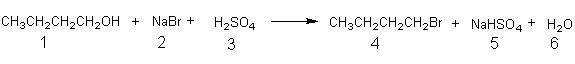
de 1.33 g de bromuro sódico (2) disueltos en 1.5 mL de agua, seguido por la adición de 0.80 mL de 1-butanol (1) y 1.1 mL (2.0 g) de ácido sulfúrico concentrado (3). Podemos entonces elaborar las siguientes tablas de reactivos (Tabla 1) y de productos deseados (Tabla 2), tal y como se muestran a continuación:
Tabla 1 Tabla de Reactivos
| Reactivo | MM | Peso Usado (g) |
Moles Usados | Moles Teóricos Necesarios | Densidad | Teb (oC) |
| 1 C4H9OH | 74.12 | 0.80 | 0.0108 | 0.0108 | 0.810 | 118 |
| 2 NaBr | 102.91 | 1.33 | 0.0129 | 0.0108 | ||
| 3 H2SO4 | 98.08 | 2.0 | 0.0200 | 0.0108 | 1.84 |
Tabla 2 Tabla de Productos
| Compuesto | MM | Rendimiento Teórico (Moles) | Rendimiento Teórico (Gramos) |
Rendimiento Real (Gramos) |
% Rendm. | Densidad | Teb (oC) |
| 4 C4H9Br | 137.03 | 0.011 | 1.48 (100%) | 1.20 | 81 | 1.275 | 101.6 |
Dividiendo la masa de cada reactivo empleado por su masa molar, obtenemos los moles correspondientes. A partir de la estequiometría de la reacción (Ecuación 1a), queda claro que se necesita un mol de cada reactivo para obtener un mol del producto (1-bromobutano), y al ser la cantidad más pequeña la correspondiente al 1-butanol (0.0108 moles) , éste será el reactivo limitante. El cálculo del rendimiento teórico (según se muestra debajo) del 1-bromobutano nos dá 1.48 g. Esto significa que, usando las
Rendimiento teórico = (moles de reactivo limitante)(relación estequiométrica; producto deseado /reactivo limitante)(MM de producto deseado)
= (moles de1-butanol)(relación estequiométrica; 1-bromobutano/1-butanol)(MM del 1-bromobutano)
=(0.0108 moles)(1 mol / 1 mol)(137.03 g/mol)
=1.48 g
cantidades de reactivos que aparecen arriba, la cantidad máxima (suponiendo un 100% de rendimiento) que se puede obtener de 1-bromobutano, es de 1.48 g. De hecho, ninguna reacción tiene lugar con un rendimiento del 100%, debido a factores tales como la formación de productos secundarios, conversión incompleta de los materiales de partida, pérdida durante el manejo de la mezcla reactiva, y pérdida por aislamiento y purificación del producto deseado. El rendimiento real típico de esta reacción es de 1-1.2 g. Asumiendo que el rendimiento real es de 1.20 g, el cálculo del rendimiento porcentual es como sigue:
Rendimiento Porcentual = (rendimiento real/rendimiento teórico) X 100
= (1.20 g/1.48 g) X 100 = 81%
De esta manera, se obtiene un rendimiento del 81%, que es muy aceptable para la mayoría de los químicos.
La Economía del Átomo para una Reacción de Sustitución
Como se indicó previamente, la mayoría de los químicos han medido la eficacia de una reacción mediante el rendimiento porcentual, pero esto sólo constituye una parte de la historia. Si consideramos la reacción anterior en la que se han empleado un total de 4.13 g de reactivos (0.8 g de 1-butanol, 1.33 g de NaBr y 2.0 g de H2SO4), en las mejores condiciones sólo obtendremos 1.48 g del producto deseado, la pregunta que deberíamos hacernos es ¿"qué pasa con el resto (4.13 g -1.48 g = 2.7 g) de la masa de los reactivos"?. La respuesta es que terminan en productos secundarios (NaHSO4 and H2O) que pueden ser de desecho, no usados, tóxicos o no reciclables/reutilizados. Como mucho un 36% (1.48 g/4.13 g X 100) de la masa de los reactivos finalizan en el producto deseado. Y si el rendimiento porcentual es del 81% ¡sólo un 29% (.81 X .36 X 100) de la masa de los reactivos terminan realmente en el producto deseado!
En un esfuerzo por promover el conocimiento de los átomos de los reactivos que se incorporan en el producto deseado y aquellos que se desperdician (o que se incorporan en productos no deseados), Barry Trost ha desarrollado el concepto de la economía del átomo.2 En 1998 Trost recibió el premio de Presidential Green Chemistry Challenge Award por este concepto. Para ilustrarlo, reconsideremos la reacción de sustitución nucleófila en medio ácido, resaltando en verde en la Ecuación 1b todos los átomos que se incorporan en el producto deseado,
Ecuación 1b
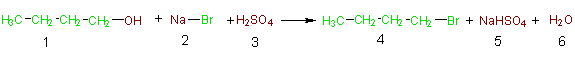
mientras que aquellos que se desperdician aparecen en marrón. De la misma forma, los átomos del producto deseado están en verde y los átomos que componen los productos de desecho en marrón. La Tabla 3 provee de otra visión de la economía del átomo para esta reacción. En las columnas 1 y 2 de esta tabla aparecen las fórmulas y los pesos fórmula de los reactivos (PF). En verde (columnas 3 y 4) estan los átomos y pesos de los átomos de los reactivos que se incorporan en el producto deseado (4), en marrón (columnas 5 y 6) aparecen los átomos y pesos de los átomos de los reactivos que terminan en los productos secundarios no deseados. Fijándonos en la última columna de esta tabla, puede apreciarse que de todos los átomos de los reactivos (4C, 12H, 5O, 1Br, 1Na y 1S) sólo 4C, 9H, y 1Br se utilizan en el producto deseado mientras que el resto (3H, 5O, 1Na, 1S) se desperdician formando parte de productos de desecho. ¡ Este es un ejemplo de una pobre economía del átomo! . Una aplicación lógica al concepto de la economía del átomo de Trost,
Tabla 3 Economía del átomo de la Ecuación 1
| Formula Reactivos |
PF Reactivos | Átomos usados | Peso de átomos usados | Átomos no usados | Peso de átomos no usados |
| 1 C4H9OH | 74 | 4C,9H | 57 | HO | 17 |
| 2 NaBr | 103 | Br | 80 | Na | 23 |
| 3 H2SO4 | 98 | _____ | 0 | 2H,4O,S | 98 |
| Total 4C,12H,5O,BrNaS |
275 | 4C,9H,Br | 137 | 3H,5O,Na,S | 138 |
es calcular el porcentaje de la economía del átomo.3 Ello se obtiene tomando la relación de la masa de los átomos utilizado (137) y la masa tota de los átomos de todos los reactivos (275) multiplicando por 100. Como se muestra a continuación, esta reacción sólo alcanza un 50% de economía del átomo.
% Economía del Átomo = (PF de los átomos utilizados/PF de todos los reactivos) X 100
= (137/275) X 100 = 50%
De esta manera, en el mejor de los casos (si el rendimiento de la reacción fuera del 100%), sólo la mitad de la masa de los reactivos se incorporarían en el producto deseado, mientras que el resto daría lugar a producto secundarios no deseados.
MATERIAL OPCIONAL
El siguiente material opcional trata de dos nuevos términos llamados economía "experimental" del átomo y "Rendimiento Porcentual X Economía experimental del átomo". Estos dos términos aclaran la eficacia de una reacción, si bién, este material puede ser omitido. Para saltarse el material opcional y volver a tratar sobre la economía del átomo y otras consideraciones medioambientales, pinchar aquí here.
En realidad, si la reacción se lleva a cabo de acuerdo con las cantidades indicadas en la Tabla 1, la economía del átomo sería incluso menor. Esto es resultado de que en la Tabla 3 se supuso que las cantidades estequiométricas para cada reactivo eran (1:1:1), como se indica en la Ecuación 1b, se consumieran en la reacción. De hecho, las cantidades de los reactivos 1, 2 y 3 que se emplearon en la reacción real, como muestra la Tabla 1, fueron 0.0108:0.0129:0.0200 = 1:1.11:1.85. La Tabla 4 muestra el término que hemos creado de economía "experimental" del átomo, que se basa en las cantidades reales de reactivos empleados en el experimento. La Tabla 4 es similar a la Tabla 3, excepto en
Tabla 4 Economía del átomo experimental de la Ecuación 1: Basada en las cantidades reales de los reactivos empleados
| Fórmula Reactivos | Peso de los reactivos (PF X moles de reactivos) |
Átomos usados | Peso de átomos usados (PF X moles) | Átomos no usados | Peso de los átomos no usados (PF X moles) |
| 1 C4H9OH | 74.0 X .0108 = .80 | 4C,9H | 57 X .0108= .62 | HO | 17 X .0108=.18 |
| 2 NaBr | 103 X .0129=1.33 | Br | 79.9X .0129=1.03 79.9X .0108=0.86 excess 0.17 |
Na | 23 X .0129=.30 excess 0.17 subtotal 0.47 |
| 3 H2SO4 | 98 X .0200= 2.0 | _____ | 0.00 | 2H,4O,S | 98.1 X .0200=1.96 |
| Total 4C,12H,5O,BrNaS |
4.13 | 4C,9H,Br | 1.48 | 3H,5O,Na,S | 2.61 |
que se contabiliza el exceso de cualquier reactivo no utilizado. En nuestro caso el NaBr (reactivo 2) se usa en exceso (.0129 moles) en comparación con el 1-butanol (.0108 moles), que es el reactivo limitante. Por consiguiente, en la cuarta columna de la Tabla 4, donde se calcula la masa de los reactivos que son realmente empleados, puede observarse que a pesar de que el bromuro (del NaBr) se utiliza en el producto deseado, hay un exceso de este elemento, el cual debe ser añadido al peso de los reactivos no utilizados. Podemos calcular ahora el término que hemos llamado Porcentaje de la economía experimental del átomo. Este se calcula simplemente dividiendo la masa de los reactivos que se emplean en el producto deseado (de la misma manera que calculamos el rendimiento teórico), por la masa real total de todos los reactivos usados en el experimento. Podemos ver en la columna 4, fila 4 de la Tabla 4, que la masa utilizada de 1.48 g y la masa total de los reactivos es de 4.13 g (fila 4, columna 2) de manera que el porcentaje de la economía experimental del átomo es (1.48/4.13 X 100) 36%. Esto no es nada más que el mismo cáculo que el
% Economía experimental del átomo = (masa de los reactivos usados en el producto deseado/masa total de todos los reactivos) X 100
= (rendimiento teórico/masa total de todos los reactivos) X 100
= (1.48 g/4.13 g) X 100 = 36%
desarrollado al principio de la exposición de la economía del átomo y representa el porcentaje máximo de masa de reactivos que puede ser incorporado en el producto deseado. Aunque se llega a la misma conclusión que antes de tratar el concepto de la economía del átomo, es útil para construir una tabla como la Tabla 4, de manera que podamos ver qué reactivo (o reactivos) son los que ocasionan una pobre economía del átomo.
Más que considerar el rendimiento porcentual y la economía (experimental) del átomo separadamente, para una mejor indicación de la eficacia de la reacción, se consideran las dos a la vez.
Para ilustrar esto, hemos creado el término Rendimiento Porcentual X Economía Experimental del Átomo (%PE .EAE), que se calcula como sigue:
% Rendimiento X Economía experimental del átomo = (rendimiento real/rendimiento teórico) X (masa de reactivos utilizados en el producto deseado/masa total de todos los reactivos) X 100
%PE .EAE= (rendimiento real/rendimiento teórico) X (rendimiento teórico/masa total de todos los reactivos) X100
= (rendimiento real/masa total de todos los reactivos) X 100
= (1.20 g/4.13 g) X 100
= 29%
Nótese que en el cálculo, el rendiminto teórico se anula, dejando una relación entre el rendimiento real y la masa total de todos los reactivos X 100. Si de nuevo consideramos que el rendimiento real es 1.20 g y lo dividimos por 4.13 g (la masa total de los reactivos de la Tabla 4) entonces el rendimiento porcentual X Economía experimental del átomo es sólo de un 29% (previamente llegamos a esta conclusión de una manera mucho menos formal, vea el primer párrafo de la sección) ¡Esto significa que sólo un 29% de la masa total de los reactivos es realmente empleada en el producto deseado y que un 71% se desperdicia!. Medir la eficacia de la reacción de esta manera lo sitúa dentro de una perspectiva totalmente nueva. Mientras que muchos químicos considerarían un rendimiento del 81% muy aceptable, no muchos estimarían como satisfactorio el aprovechamiento de sólo un 29% de la masa de los átomos reactivos.
Aquí concluye el material opcional
Otras Consideraciones Medioambientales
A pesar de que considerar a la vez la economía del átomo y el rendimiento porcentual, nos dá una mayor información acerca de la eficacia de la reacción y su tolerancia medioambiental, se necesitan examinar otros factores. Para impulsar el debate acerca de la tolerancia medioambietal, es conveniente analizar los Doce Principios de la Química Verde (ver debajo). Los Principios 1 y 2 están directamente dirigidos hacia la economía del átomo y el rendimiento.
LOS DOCE PRINCIPIOS DE LA QUÍMICA VERDE4
1. Es preferible evitar la producción de un residuo que tratarlo o limpiarlo
una vez que se haya formado.
2. Los métodos de síntesis deberán diseñarse de manera que incorporen al
máximo, en el producto final, todos los materiales usados durante el
proceso.
3. Siempre que sea posible, los métodos de síntesis deberán diseñarse para
utilizar y generar sustancias que tengan poca o ninguna toxicidad, tanto
para el hombre como para el medio ambiente.
4. Los productos químicos deberán ser diseñados de manera que mantegan
su eficacia a la vez que reduzcan su toxicidad.
5. Se evitará, en los posible, el uso de sustancia auxiliares (disolventes,
reactivos de separación, etc.) y en el caso de que se utilicen que sean lo
más inocuos posible.
6. Los requerimientos energéticos serán catalogados por su impacto
medioambiental y económico, reduciéndose todo lo posible. Se intentará
llevar a cabo los métodos de síntesis a temperatura y presión ambientes.
7. La materia prima ha de ser preferiblemente renovable en vez de agotable,
siempre que sea técnica y económicamente viable.
8. Se evitará en lo posible la formación de derivados (grupos de bloqueo, de
protección/desprotección, modificación temporal de procesos
físicos/químicos).
9. Se emplearán catalizadores (lo más selectivos posible) en vez de reactivos
estequiométricos.
10. Los productos químicos se diseñarán de tal manera que al finalizar su
función no persistan en el medio ambiente sino que se transformen en
productos de degradación inocuos.
11. Las metodologías analíticas serán desarrolladas posteriormente para
permitir una monitorización y control en tiempo real del proceso, previo
a la formación de sustancias peligrosas.
12. Se elegirán las sustancias empleadas en los procesos químicos de forma
que se minimice el potencial de accidentes químicos, incluidas las
emanaciones, explosiones e incendios.
Los Principios 3 y 4 tratan de la toxicidad de todas las sustancias empleadas en la reacción, incluidos los reactivos y los productos. Considerando la Ecuación 1, queda claro que los dos hidrógenos y el oxígeno que dan lugar al agua, se desperdician. Sin embargo, si una reacción dá lugar a un producto de desecho, en el caso de que sea agua, ésta es beneficiosa para el medio ambiente (no tóxica y no presenta problemas de eliminación si es pura). No obtante, todos los productos y reactivos deberán ser evaludados en cuanto a su toxicidad. Encontramos ejemplos admirables de formación de productos menos tóxicos, pero igualmente eficaces, en los nuevos plaguicidas desarrollados por Rohm y Haas para el control de insectos insects y para el control de organismos marinos contaminantes marine fouling organisms. Estos nuevos tipos de plaguicidas han ganado el Premio de La Presidencia a los Retos de la Química Verde.
El Principio #5 sugiere la consideración de las sustancia auxiliares (disolventes, reactivos de separación, agentes secantes, etc.) que se emplean en las reacciones y las síntesis. Aunque el agua se usa como un disolvente (provechoso para el medio ambiente5), en un proceso experimental típico1 llevado a cabo por la Ecuación 1, la terminación del producto (1-bromobutano) después de destilar, requiere 1 mL de ácido sulfúrico concentrado, 1 mL de hidróxido sódico 3M, cloruro cálcico anhidro, 1 mL de etanol, 1 mL de acetona y 2 mL de p-xileno, todo ello para obtener sólo de 1-1.2 g de1-bromobutano! Queda claro que el residuo generado por estas sustancias auxiliares es significativo y supera la cantidad de desperdicio (al menos desde el punto de vista de la masa) generado directamente por la reacción. Muchas reacciones orgánicas utilizan grandes cantidades de disolventes que con frecuencia son tóxicos. Muchos de ellos finalizan en el agua, suelo y aire dando como resultado una contaminación significativa del medio ambiente. Los esfuerzon se dirigen a reemplazar los disolventes orgánicos por agua, dióxido de carbono y líquidos iónicos a temperatura ambiente. De hecho, Joseph DeSimone de la Universidad de Carolina del Norte ha sido galardonado con el Premio de La Presidencia a los Retos de la Química Verde, por su trabajo sobre el desarrollo de dispersantes para el dióxido de carbono líquido o fluido supercrítico surfactants for liquid and supercritical carbon dioxide. Como resultado de los esfuerzos del Dr. DeSimone, se ha desarrollado un proceso que emplea dióxido de carbono líquido para la limpieza en seco de ropa. Este proceso recicla el dióxido de carbono, que se obtiene como residuo de otros procesos químicos y permite sustituir al percloroetileno perchloroethylene, cuyos efectos sobre la salud han sido debatidos.
El Principio #6 considera las necesidades energéticas de una reacción. Es preferible llevar a cabo reacciones a presión y temperatura ambientes, aunque muchas reacciones químicas requieren calor y/o frío y presiones distintas a las ambientales. Esto supone el uso de una fuente de energía y la mayoría de las veces esta energía procede de un combustible fósil. Para desarrollar y obtener el 1-bromobutano de la Ecuación 1, se necesita un proceso de reflujo y dos destilaciones. Por lo que sus necesidades energéticas son significativas.
La mayoría de las sustancas orgánicas de partida, tales como el 1-butanol de la Ecuación 1, derivan en último término del petróleo crudo, una fuente no renovable y agotable. El Principio #7 induce a considerar si estos materiales de partida pueden obtenerse de fuentes renovables. Generalmente, las fuentes renovables se refieren a materiales biológicos o procedentes de las plantas (biomasa). El dióxido de carbono y el metano también se consideran como fuentes renovables, ya que ambos pueden ser generados tanto de métodos naturales como sintéticos. El trabajo de Draths and Frost at Michigan State, Mark Holtzapple at Texas A&M, y Biofine Corporation para obtener material de partida químico a partir de la biomasa, han logrado un premio de La Presidencia a los Retos de la Química Verde.
Algunos podrían referirse de forma errónea, a la reacción descrita por la Ecuación 1, como una reacción catalizada por ácido, cuando de hecho es realmente una reacción promovida por un ácido. Esto se debe al hecho de que el ácido sulfúrico, en esta reacción, se requiere en cantidades estequiométricas en vez de catalíticas. Según indica el Principio #9, los reactivos usados en cantidades catalíticas son preferibles a los usados en cantidades estequiométricas. Considerando que se necesita un mol de ácido sulfúrico por cada un mol de agua eliminado en esta reacción, entonces sólo serán provechosas cantidades estequiométricas de este reactivo. Sin embargo, aunque se usen cantidades estequiométricas, siempre que sea posible, se realizarán los procesos de recuperación, reciclado y reutilización de los productos no deseados. Recientemente se han logrado grandes progresos desarrollando reacciones que son promovidas por catalizadores no tóxicos y recuperables. Un proceso biocatalítico descubierto y desarrollado port Lilly Research Laboratories for producing a potential anticonvulsant drug ha ganado uno de los Premios de La Presidencia a los Retos de la Química Verde.
La Economía del átomo en Reacciones de Eliminación
En todas las explicaciones restantes acerca de la eficacia de una reacción, nos limitaremos a la economía del átomo basada en la estequiometría de la reacción. Cuando nos encontramos con estas reacciones en el laboratorio, es conveniente calcular la economía del átomo basándose en las cantidades de los reactivos empleados (economía experimental del átomo ). Pero también se deben hacer otras consideraciones tales como la toxicidad, el uso de energía, el empleo de sustancias auxiliares, los catalizadores frente a los reactivos estequiométricos y las materias primas renovables frente a las no renovables.
En la reacción de sustitución anterior (Ecuación 1a), quedó claro el resultado de una pobre economía del átomo como consecuencia del hecho de que los átomos del grupo saliente (OH) que va a ser reemplazado, el acompañante (sodio) del nucleófilo (bromuro), y el ácido sulfúrico requerido, serán todos residuos en forma de productos no deseados de esta reacción. En virtud de que las reacciones de eliminación requieren sólo de la pérdida de átomos (sin necesidad de ganar ninguno) del reactivo, ello significa que estas reacciones, en términos de su economía del átomo, son en general incluso peores que las reacciones de sustitución.
Como ejemplo, consideremos la siguiente reacción de eliminación. La deshidrohalogenación, promovida por una base, de los haluros de alquilo, es un método muy común para la producción de alquenos, a partir de los haluros de alquilo, por eliminación. En la Ecuación 2 la formación del metilpropeno se obtiene a partir de la reacción del 2-bromo-2-metilpropano (7) con etóxido sódico (8). En esta reacción, los átomos de los reactivos que se incorporan en el producto deseado (9) y los átomos del producto deseado, aparecen en verde, mientras que los átomos no empleados de los reactivos se muestran en marrón, al igual que los átomos de los productos no deseados de la reacción. La Tabla 5 ilustra la economía del átomo para esta reacción y el cálculo del porcentaje de economía del átomo da un valor muy bajo del 27%.
Ecuación 2
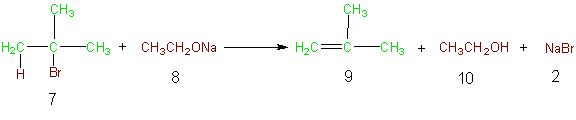
Tabla 5 Economía del átomo de la Ecuación 2
| Fórmula Reactivos | PF Reactivos | Átomos usados | Peso de los átomos usados |
Átomos no usados | Peso de los átomos no usados |
| 7 C4H9Br | 137 | 4C,8H | 56 | HBr | 81 |
| 8 C2H5ONa | 68 | ____ | 0 | 2C,5H,O,Na | 68 |
| Total 6C,14H,O,Br,Na |
205 | 4C,8H | 56 | 2C,6H,O,Br,Na | 149 |
% Economía del átomo= (PF átomos usados/PF de todos los reactivos) X 100
= (56/205) X 100 = 27%
Esta baja economía del átomo es resultado, no sólo de la pérdida de HBr sino también de que es una reacción promovida por una base, el etóxido sódico, cuyos átomos aparecen en los productos secundarios no deseados.
Economía del átomo en reacciones de adición
Debido a que, en general, las reacciones de adición dan lugar a la incorporación de todos los átomos de los reactivos en los productos finales deseados, estas reacciones tienen como resultado una elevada economía del átomo. Desde este punto de vista, las reacciones de adición son preferibles para el medio ambiente, que las de eliminación o sustitución. Consideremos el caso de la siguiente reacción de adición del bromuro de hidrógeno al metil propeno. En este ejemplo, todos los átomos de los reactivos (9 y 11) aparecen en verde, ya que todos son empleados en el producto final deseado (7). La Tabla de la economía del átomo (Tabla 6) y la obtención de un porcentaje de la economía del átomo del 100% enfatiza la excelente economía del átomo para esta reacción.
Ecuación 3
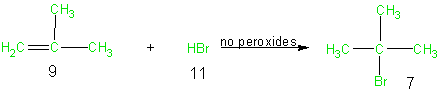
Tabla 6 Economía del átomo de la Ecuación 3
| Fórmula Reactivos | PF reactivos | Átomos usados | Peso de los átomos usados | Átomos no usados | Peso de los átomos no usados |
| 9 C4H8 | 56 | 4C,8H | 56 | ____ | 0 |
| 11 HBr | 81 | HBr | 81 | ____ | 0 |
| Total 4C,9H,Br |
137 | 4C,9H,Br | 137 | ____ | 0 |
% Economía del átomo = (PF de los átomos usados/PF de todos los reactivos) X 100
= (137/137) X 100 = 100%
Economía del átomo en reacciones de reagrupamiento
Las reacciones de reagrupamiento implican la reorganización de los átomos de una molécula. Como no se produce ni eliminación, ni adición, ni sustitución en la molécula en la que tiene lugar el reagrupamiento, la economía del átomo es del 100%, por lo que para el medio ambiente, estas reacciones son preferibles, desde el punto de vista de la economía del átomo. Para ilustrar esto, consideremos la reacción de reagrupamiento del 3,3-dimetil-1-buteno (12) a 2,3-dimetil-2-buteno (13), catalizada por un ácido. En este caso, todos los átomos del reactivo 12 aparecen en verde ya que se incorporan en su totalidad en el producto deseado 13. Como en los ejemplos anteriores podemos elaborar una tabla de la economía del átomo y calcular su porcentaje. Como el ácido (H+) empleado en esta reacción no se incorpora en el producto deseado, y se usa sólo en cantidades catalíticas, se muestra en negro y no en verde o marrón, a la vez que tampoco se considera para elaborar la tabla y calcular la economía del átomo. Como se predijo anteriormente, el porcentaje de la economía del átomo de esta reacción es del 100%.
Ecuación 4
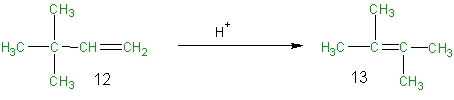
Tabla 7 Economía del átomo de la Ecuación 4
| Fórmula Reactivos | PF reactivos | Átomos usados | Peso de los átomos usados | Átomos no usados | Peso de los átomos no usados |
| 12 C6H12 | 84 | 6C,12H | 84 | ____ | 0 |
| Total 6C,12H |
84 | 6C,12H | 84 | ____ | 0 |
% Economía del átomo = (PF de los átomos usados/PF de todos los reactivos) X 100
= (84/84) X 100 = 100%
En principio todas las reacciones orgánicas pueden catalogarse como reacciones de sustitución, adición, eliminación o reagrupamiento. Desde la perspectiva de la economía del átomo, las reacciones de adición y reagrupamiento, son preferibles para el medio ambiente, seguidas por la de sustitución, mientras que las de eliminación son las menos favorecidas. En el estudio de la Química, al encontrarnos con una reacción, deberemos examinarla no sólo desde el punto de vista del rendimiento, sino también desde el de la economía del átomo de la misma.
Economía del átomo en la Síntesis
El concepto de la economía del átomo puede aplicarse también en las reacciones de síntesis. Para determinar la economía del átomo de una síntesis, simplemente deberemos determinar, cuáles de los átomos de los reactivos, en todos los pasos de la síntesis, se incorporan en el producto final deseado.
Síntesis del Oxido de Etileno
Para explidar el concepto de la economía del átomo en una síntesis, consideremos la síntesis indusrtial del óxido de etileno (19). El óxido de etileno es el producto de partida en la síntesis del etilen glicol (usado como anticongelante), etoxilatos (dispersantes), éteres de glicol y polímeros (como el PET). A nivel mundial, se producen aproximadamente 8,800 milliones de libras de este compuesto al año. La síntesis tradicional (Esquema 1) del óxido de etileno (19) consiste en dos pasos y se conoce como la ruta de la clorhidrina. Los átomos del reactivo que se incorporan en el producto final deseado (19), y los de éste se muestran en verde, mientras
Esquema 1 Ruta de la clorhidrina para el óxido de etileno
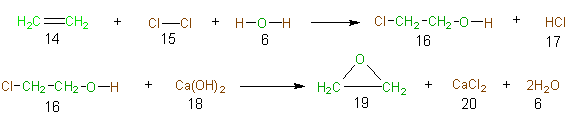 green, and those atoms of the shown in green, while the atoms of the reactants
green, and those atoms of the shown in green, while the atoms of the reactants
que los átomos de los reactivos que terminan en productos no deseados (junto con los átomos de los productos no deseados) aparecen en marrón. La Tabla 8 es la correspondiente a la economía del átomo de la ruta de la clorhidrina para el óxido de etileno, y nos permite calcular la baja economía del átomo (23%) de la misma.
Tabla 8 Economía del átomo del Esquema 1, Ruta de la clorhidrina para el óxido de etileno
| Fórmula Reactivos | PF de reactivos | Átomos usados | Peso de los átomos usados | Átomos no usados | Peso de los átomos no usados |
| 14 C2H4 | 28 | 2C,4H | 28 | _____ | 0 |
| 15 Cl2 | 71 | _____ | 0 | 2Cl | 71 |
| 6 H2O | 18 | O | 16 | 2H | 2 |
| 18 Ca(OH)2 | 72 | _____ | 0 | Ca,4H,2O | 72 |
| Total 2C,8H,3O,Ca,2Cl |
189 | 2C,4H,O | 44 | 6H,2O,Ca,2Cl | 145 |
% Economía del átomo = (PF de los átomos usados/PF de todos los reactivos) X 100
= (44/189) X 100 = 23%
Se ha desarrollado una ruta catalítica (Esquema 2) para la obtención del óxido del etileno a partir de etileno. En esta síntesis de un sólo paso, el otro reactivo empleado, aparte del etileno, es 1/2 mol de oxígeno. Como se puede apreciar en el Esquema 2 y en la Tabla 9, todos los átomos del reactivo se incorporan en el producto final deseado y por consiguiente el porcentaje de la economía del átomo que se alcanza es del 100%. Este valor no es sorprendente, ya que es una reacción de adición, y como se indicó previamente, las reacciones de adición presentan una economía del átomo del 100%.
Esquema 2 Ruta catalítica para el óxido de etileno
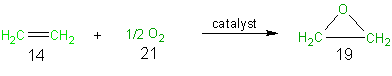
Tabla 9 Economía del átomo del Esquema 2, Ruta catalítica para óxido de etileno
| Fórmula Reactivos | PF reactivos | Átomos usados | Peso de los átomos usados | Átomos no usados | Peso de los átomos no usados |
| 14 C2H4 | 28 | 2C,4H | 28 | _____ | 0 |
| 21 1/2 O2 | 16 | O | 16 | _____ | 0 |
| Total 2C,4H,1Ol |
44 | 2C,4H,O | 44 | _____ | 0 |
% Economía del átomo = (PF de los átomos usados/PF de todos los reactivos) X 100
= (44/44) X 100 = 100%
Síntesis del Ibuprofeno
Síntesis del Ibuprofeno de la Compañía Boots
El Ibuprofeno es el ingrediente activo de varias marcas de productos comerciales como Advil, Motrin y Nuprin. El Ibuprofeno actúa como analgésico (alivio del dolor) y también es efectivo como medicamento Antiinflamatorio No Esteroidal (NSAID). Los NSAIDs reducen la inflamación producida por la artritis, osteroartritis y reumatismo. Al Ibuprofeno se le conoce como medicamento antiinflamatorio no esteroidal ya que no forma parte de la familia de los esteroides.
La producción mundial de ibuprofeno supera las 30 milliones de libras al año. La Compañía Boots PLC de Nottingham, Inglaterra fue la primera en patentar la síntesis del ibuprofeno en la década de los 60 (E.U. Patente 3,385,886) y ha servido como método principal de síntesis durante muchos años. La síntesis del ibuprofeno de la compañía Boots se muestra en el Esquema 3. Como siempre
Esquema 3 Síntesis Boots del Ibuprofeno
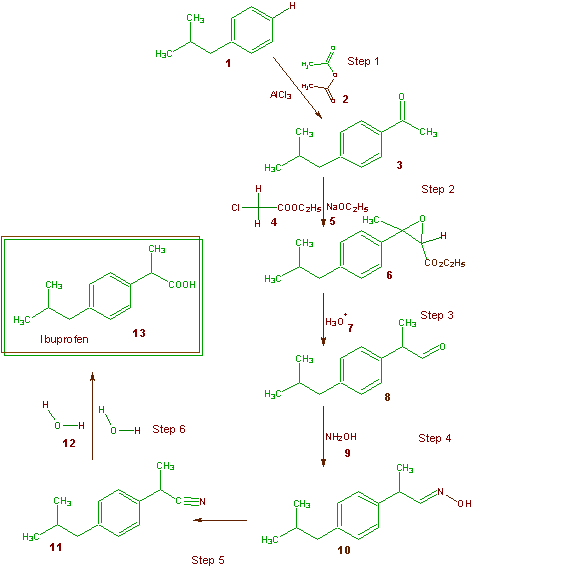
todos los átomos de cada reactivo que se incorporan en el producto final deseado (ibuprofeno) aparecen en verde, y todos aquellos que terminan en productos no deseados en marrón. La Tabla 10 ilustra la economía del átomo de la síntesis de la Compañía Boots y permite calcular un porcentaje de la economía del átomo de un 40%. Como se indicó anteriormente, se producen aproximadamente unas 30 millones de libras al año de ibuprofeno. Si toda la producción mundial del ibuprofeno fuera realizada por el proceso Boots, ¡se generarían alrededor de 35 millones de libras de residuos!
Tabla 10 Economía del átomo del Esquema 3, Síntesis del Ibuprofeno de la Compañía Boots
| Fórmula Reactivos | PF de los reactvos | Átomos usados | Peso de los átomos usados | Átomos no usados | Peso de los átomos no usados |
| 1 C10H14 | 134 | 10C,13H | 133 | H | 1 |
| 2 C4H6O3 | 102 | 2C,3H | 27 | 2C,3H,3O | 75 |
| 4 C4H7ClO2 | 122.5 | C,H | 13 | 3C,6H,Cl,2O | 109.5 |
| 5 C2H5ONa | 68 | _____ | 0 | 2C,5H,O,Na | 68 |
| 7 H3O | 19 | _____ | 0 | 3H,O | 19 |
| 9 NH3O | 33 | _____ | 0 | 3H,N,O | 33 |
| 12 H4O2 | 36 | H,2O | 33 | 3H | 3 |
| Total 20C,42H,N,10O, Cl,Na |
514.5 | Ibuprofen 13C,18H,2O |
Ibuprofen 206 |
Waste Products 7C,24H,N,8O, Cl,Na |
Waste Products 308.5 |
% Atom Economy = (FW of atoms utilized/FW of all reactants) X 100
= (206/514.5) X 100 = 40%
% Economía del Atomo = (PF de los átomos usados/PF de todos los reactivos) X 100
= (206/514.5) X 100 = 40%
Síntesis del Ibuprofeno de la Compañía BHC
En los años 80 se aprobó la venta sin receta médica del ibuprofeno expirando la patente de la Compañía Boots. El reconocimiento de las oportunidades financieras que la producción y venta de éste medicamento podrían ofrecer, hizo que varias compañías se embarcaran en la construcción de las instalaciones y en desarrollar nuevos métodos para la preparación del ibuprofeno. La Corporación Hoechst Celanese Corporation (Somerville, NJ; conocida ahora como Corporación Celanese) descubrió una nueva síntesis del ibuprofeno en tres pasos. Junto con la Compañía Boots fundaron la Compañía BHC, para preparar (mediante la nueva síntesis) y comercializar el ibuprofeno. La síntesis de la compañía BHC se muestra en el Esquema 4, y posteriormente, en la Tabla 11, se ilustra la economía del átomo cuyo cálculo de porcentaje dá un 77%, con una mejora significativa sobre el obtenido por el proceso de la Compañía Boots del 40%.
Esquema 4 Síntesis del Ibuprofeno de la compañía BHC
Tabla 11 Economía del átomo del Esquema 4, Síntesis del Ibuprofeno de la Compañía BHC
| Fórmula Reactivos | PF reactivos | Átomos usados | Peso de los átomos usados | Átomos no usados | Peso de los átomos no usados |
| 1 C10H14 | 134 | 10C,13H | 133 | H | 1 |
| 2 C4H6O3 | 102 | 2C,3H,O | 43 | 2C,3H,2O | 59 |
| 4 H2 | 2 | 2H | 2 | _____ | 0 |
| 6 CO | 28 | CO | 28 | _____ | 0 |
| Total 15C,22H,4O |
266 | Ibuprofen 13C,18H,2O |
206 | Waste Products 2C,3H,2O |
60 |
% Economía del átomo = (PF de los átomos usados/PF de todos los reactivos) X 100
= (206/266) X 100 = 77%
La economía del átomo del proceso de la Compañía BCH puede alcanzar un valor > 99% si consideramos que el ácido acético generado en el Paso 1 es recuperado y usado.
El proceso de la Compañía BCH ofrece no sólo una importante mejora en la economía del átomo sino también otras ventajas para el medio ambiente. En éstas se incluye un proceso catalizado de tres pasos frente al proceso de seis pasos de la Compañía Boots, que requiere reactivos auxiliares en cantidades estequiométricas. Por ejemplo, el primer paso de cada proceso dan lugar al mismo producto (3) a partir de los mismos reactivos (1 y 2). Sin embargo, el proceso de la Compañía Boots emplea tricloruro de alumnio en cantidades estequiométricas (que no se han considerado en la Tabla 10), mientras que el proceso de la Compañía BHC, utiliza HF en cantidades catalíticas, que es recuperado y reusado repetidamente. El tricloruro de alumninio produce grandes cantidades de tricloruro de aluminio hidratado como residuo que generalmente se lleva a vertedero. Los catalizadores de níquel y paladio empleados en los pasos 2 y 3 del proceso de la Compañía BHC también son recuperados y reutilizados.
Debido a que el proceso de la Compañía BHC consta sólo de tres pasos (frente a los seis pasos del proceso de la Compañía Boots) y a que presenta una mejora en la economía del átomo, ello se traduce en una disminución importante de los residuos producidos y una mayor productividad (más cantidad de ibuprofeno en menos tiempo y con menos equipo). Estos factores suponen unos beneficios económicos para la Compañía como resultado del hecho de necesitar menos dinero para tratar el residuo generado y de requerir un menor desembolso para producir la misma cantidad de ibuprofeno. De esta manera existe no sólo un beneficio para el medio ambiente, sino que el saldo de la compañía se ve fortalecido, cosechando una buena imagen frente a la sociedad por haber hecho verde el proceso.
Por el desarrollo de la síntesis del ibuprofeno, la Compañía BCH recibió el prestigiosos premio Presidential Green Chemistry Challenge award en 1997 y también el destacado Premio Kirpatrick a la Ingeniería Química6 en 1993. El premio Kirpatrick se otorga cada dos años por la revista Chemical Engineering como reconocimiento a los esfuerzos relevantes de un grupo en el desarrollo y comercialización en la tecnología de procesos.
Resumen
La economía del átomo y la economía experimental del átomo se enfocan hacia el cálculo del rendimiento de una reacción y ofrece una segunda forma de medir la eficacia de una reacción, considerando los átomos usados o no de los reactivos. El porcentaje de la economía del átomo y el porcentaje de la economía experimental del átomo, nos ofrece los conceptos para cuantificar la economía del átomo, permitiendo realizar una comparación cuantitativa de la economía del átomo de una reacción (o síntesis) frente a otra. Quizás la mejor medida de la eficacia de una reacción sea considerar a la vez tanto la economía del átomo como el rendimiento mediante el cálculo de rendimiento porcentual X economía experimental del átomo (PE .EAE). Por supuesto, para valorar la conveniencia de una reacción para el medio ambiente no sólo se debería considerar la eficacia de la reacción sino también otros factores (ya comentados) como la toxicidad, el uso de sustancias auxiliares, los requerimientos energéticos, el origen de la materia prima y los catalizadores frente a los reactivos estequiométricos.
Cuestiones
1. Defina los siguientes términos
a) economía del átomo
b) % de la economía del átomo
c) rendimiento porcentual
d) % de la economía experimental del átomo
c) %PE .EAE
2. ¿Cuál de los términos de la pregunta 1 sólo es significativo con los resultados experimentales? ¿Qué resultado experimental es necesario para hacer estos términos significativos?
3. Considere las siguientes reacciones.
a) Clasifíquelas como reacción de sustitución, eliminación, adición o reagrupamiento.
b) Reescriba cada reacción asegurándose de que está ajustada. Marque todos los átomos de reactivos que se incorporan en el producto final deseado y los átomos del producto deseado en verde, y todos los demás átomos en marrón.
c) Prepare una tabla de la economía del átomo, análoga a la Tabla 3, para cada reacción.
d) Calcule el % de la economía del átomo para cada reacción.
![]()
![]()
![]()
![]()
4. Como se indica en la referencia 3, Roger Sheldon ha desarrollado un término muy similar al % de la economía del átomo, llamada % del uso del átomo. El % del uso del átomo puede calcularse de acuerdo a la siguiente ecuación
% Uso del átomo = (MM del producto deseado/MM de todos los productos) X 100
a) Compárelo y contrástelo con el % de la economía del átomo.
b) Con la información dada en los Esquemas 3 y 4, se puede calcular el % del uso del átomo para estas síntesis. Explique sus respuestas.
c) ¿Qué concepto, aprendido en la Química del primer año, hace iguales los porcentajes reales calculados para el porcentaje del uso del átomo y el porcentaje de la economía del átomo?. Compruébelo calculando el % del uso del átomo para cada una de las reacciones de la pregunta 3 y compare los resultados con el % de la economía del átomo que calculó en la pregunta 3.
5. Considere la siguiente síntesis endos pasos del 2-pentino
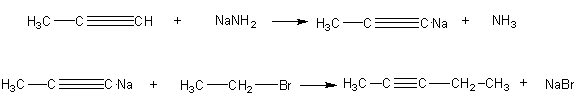
a) Reescriba la reacción asegurándose de que está ajustada. Muestre todos los átomos de los reactivos que se incorporan al producto deseado y los de éste en verde, y el resto de los demás átomos en marrón.
c) Prepare una tabla de la economía del átomo para esta síntesis análoga a la Tabla 7.
d) Calcule el % de la economía del átomo de la síntesis.
e) Calcule el % del uso del átomo de esta síntesis.
.
6. Su profesor le guiará en un experimento correspondiente a su libro de texto del laboratorio. Haciendo referencia a este laboratorio:
a) Escriba una ecuación ajustada que muestre los átomos de los reactivos que se incorporan al producto deseado y los átomos de éste en verde, y el resto de los demás átomos en marrón.
b) Construya una tabla de la economía del átomo análoga a la Tabla 3.
c) Calcule el % de la economía del átomo.
d) Construya una tabla para la economía del átomo experimental análoga a la Tabla 4.
e) Calcule la economía experimental del átomo.
f) Asumiendo que esta reacción dá un 80% de rendimiento. Calcule el %PE .EAE.
g) ¿Cuáles son los requerimientos energéticos para esta reacción?
h) ¿Se emplean sustancias auxiliares en la misma?
i) ¿Qué reactivos se usan en cantidades estequiométricas?
j) ¿Qué reactivos se usan en cantidades catalíticas?
7. Proporcione un mecanismo para el Paso 1 de la síntesis del ibuprofeno de la Compañía BCH. ¿Está este paso promovido o catalizado por el ácido?
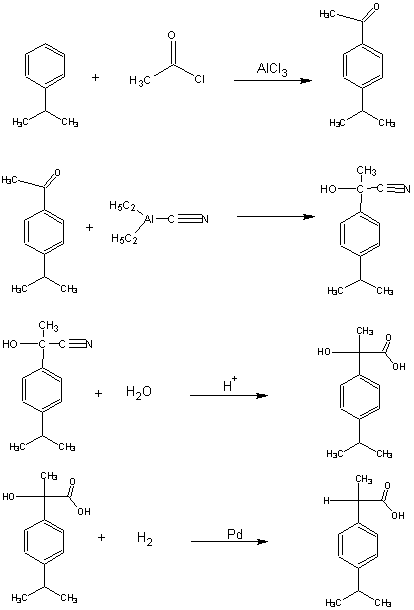
8. La tercera síntesis del ibuprofeno, llamada síntesis etilo, se muestra a continuación.
a) Reescriba la síntesis mostrando los átomos de los reactivos incorporados al producto desado y los de éste, en verde, y el resto de los demás átomos en marrón.
b) Prepare una tabla de la economía del átomo para la síntesis análoga a la Tabla 7.
d) Calcule el % de la economía del átomo para ésta síntesis.
.
Notas y Referencias Bibliográficas
1. Williamson, Kenneth L., Macroscale and Microscale Organic Experiments, 2nd ed., D. C. Heath and Co., 1994, 247-252.
2. Trost, Barry M., The Atom Economy-A Search for Synthetic Efficiency. Science 1991, 254, 1471-1477.
3. Cann, Michael C.; Connelly, Marc E. Real-World Cases in Green Chemistry; ACS, Washington, 2000. Roger Sheldon of Delft University has developed a very similar concept called % atom utilization. Sheldon, Roger A. Organic Synthesis-Past, Present and Future. Chem. Ind. (London), 1992, (Dec), 903-906.
4. Anastas, Paul T., and Warner, John C. Green Chemistry Theory and Practice, Oxford University Press, New York, 1998.
5. There is a significant effort underway to reduce the use of organic compounds as solvents for reactions and replacement of these with water or even better yet no solvent at all.
6. Westheimer, T. The Award Goes to BHC. Chem. Eng. 1993, (Dec.), 84-95.