Green Chemistry
Greening Across the Chemistry Curriculum English | Versión en Español  | Versão em Português (Brasil)
| Versão em Português (Brasil) 
Un Módulo de Química Verde
Sugerencia: Incluir en un curso de Química General durante la impartición de diagramas de fase, fluidos supercríticos y polaridad molecular.
Donna Narsavage-Heald, Chemistry Department, University of Scranton
* La versión en español ha sido realizada por los profesores Dra. Mª de la Concepción F. Ling Ling y Dr. Sebastián O. Pérez Báez del Dpto. de Ingeniería de Procesos, E.T.S.I.I., Universidad de Las Palmas de Gran Canaria, España.
Los compuestos orgánicos volátiles (COVs) y los compuestos orgánicos halogenados se utilizan en una amplia variedad de industrias para distintos tipos de limpieza. Algunas aplicaciones en las que se usan estos compuestos como disolventes son las siguientes:
Por otro lado, los consumidores utilizan muchos productos de limpieza que contienen tanto COVs como compuestos orgánicos halogenados. Algunos ejemplos incluyen:
- limpiadores de fundentes
- limpiadores de aceite y grasa de materiales metálicos
- limpieza de ropa
Se estima que el consumo de COVs y compuestos orgánicos halogenados en todo el mundo supera los 30 billones de libras al año, muchos de los cuales constituyen una amenaza para la calidad de nuestro aire, suministro de agua, la capa de ozono y nuestra salud personal. Veamos brevemente, algunos ejemplos de estos disolventes, su uso y el efecto que tienen sobre nuestro medio ambiente.
- tintes y barnices
- disolventes de pinturas
- quitaesmalte de uñas
- pegamentos
- pulidores para muebles
- laca para el pelo
Compuestos Orgánicos Volátiles (COVs)
Figura 1. Origen de los COVs (de la epa web site)
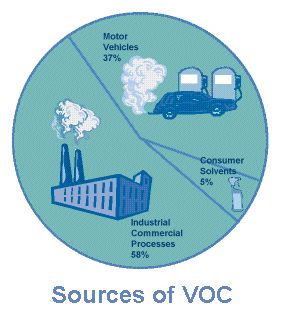
VOCs include solvents such as xylene, toluene, benzene, methylene chloride, chloroform, and isopropyl alcohol. They are widely used in industry because they are relatively non polar and are therefore effective in dissolving oil, wax, and grease. Additionally, the average consumer uses many VOCs on a daily basis. VOCs are also present in gasoline, paints, glues, varnishes, and household cleaning products. VOCs are released from burning fuel (gasoline, oil, wood coal, natural gas, etc.), and automobiles are a major source of VOCs.
Los COVs incluyen disolventes como el xileno, tolueno, benceno, cloruro de metileno, cloroformo y alcohol isopropílico. Se usan ampliamente en la industria debido a su carácter relativamente no polar siendo, por consiguiente, muy efectivos para disolver aceites, ceras y grasas. Además, el consumidor medio emplea gran cantidad de COVs en sus productos diarios. Los COVs se encuentran también en las gasolinas, pinturas, pegamentos, barnices y productos de limpieza doméstica. También se emiten durante la combustión de carburantes (gasolina, aceite, madera, carbón, gas natural, etc.) siendo los automóviles la fuente principal de COVs.
Se les llaman compuestos orgánicos volátiles debido a que poseen una alta presión de vapor y en consecuencia se evaporan fácilmente a temperatura ambiente. Esta alta presión de vapor es el resultado de las débiles fuerzas intermoleculares entre estas moléculas no polares. Debido a su volatilidad, se pueden emplear para limpiar materiales delicados como componentes electrónicos o jerseis de lana sin tener que calentar para evaporar el disolvente. Como consecuencia también de su volatilidad, escapan facilmente hacia la atmósfera reduciendo la calidad del aire.
Los COVs reaccionan con el óxido nítrico, en presencia de la luz, para formar ozono (O3) y otros contaminantes (Esquema 1). El ozono es el componente principal de la niebla fotoquímica y de la contaminación en muchas ciudades del mundo. Además, los contaminantes que se producen por reacción entre la luz solar con los COVs y el óxido nítrico, incluyen el ácido nítrico (el cual dá lugar a la lluvia ácida), aldehídos, cetonas y otros compuestos que resultan de la oxidación parcial de los COVs.
Figura 2. Atmósfera terrestre (de la epa web site)

Si bien existe una gran preocupación sobre el perjuicio de la disminución de la capa de ozono estratosférica ozone (Figura 2), por el contrario, su producción en la troposfera ocasiona un riesgo importante para la salud. La troposfera constituye la parte de la atmósfera en la que vivimos y la relación en cuanto a su presencia en el aire que respiramos es que hay mucho del mismo. Una exposición frecuente al ozono puede producir daños permanentes en los pulmones, dolor en el pecho, tos, congestión y náuseas. El ozono troposférico incluso daña a las plantas haciéndolas más susceptibles a los insectos, enfermedades y otros contaminantes. Pinche aquíClick here para saber más acerca de los niveles de ozono en donde vive.
Compuestos Orgánicos Halogenados
Los compuestos orgánicos halogenados son compuestos carbonados que contienen átomos de halógenos como flúor, cloro y bromo. Las dos clases principales de estos compuestos son los clorofluorcarbonados (CFCs) y los hidroclorofluorcarbonados (HCFCs). En general son poco reactivos, no tóxicos y no inflamables. Estas propiedades han contribuido a su popularidad en cuanto al uso como disolventes para limpieza industrial. Además estas sustancias han sido ampliamente usadas como refrigerantes, propelentes para aerosoles y agentes soplantes. Los nombres y fórmulas de algunos de los CFCs y HCFCs más comunes se muestran en la tabla siguiente:
triclorofluormetano |
monoclorodifluormetano |
diclorodifluormetano |
diclorotrifluoretano |
A pesar de que los CFCs poseen propiedades que los hacen excelentes disolventes y por tanto útiles para muchas aplicaciones, es bien conocido que se descomponen en la estratosfera bajo la influencia de la radiación ultravioleta de alta energía (UV-C). Los productos de la descomposición catalizan reacciones que reducen la capa de ozono estratosférico ozone dando como resultado un aumento significativo en la radiación UV dañina que alcanza la superficie de la tierra. Como consecuencia y bajo el Acta del Aire Limpio Clean Air Act de 1990, los CFCs no pueden ser producidos ni importados en los Estados Unidos. Los HCFCs han estado reemplazando de forma temporal a los CFCs porque no presentan un peligro potencial en la reducción de la capa de ozono. El enlace carbono-hidrógeno les hace más reactivos que los CFCs de manera que la mayoría de las moléculas de HCFC se destruyen en la troposfera. Ello previene que las moléculas de HCFC alcancen la estratosfera en donde también podrían reducir la capa de ozono.
Química Verde
Dióxido de Carbono: Disolvente alternativo a los COVs y los Compuestos Orgánicos Halogenados, y preferible para el medio ambiente
Debido a los muchos efectos negativos sobre el medio ambiente que tienen los COVs y los disolventes halogenados, es importante encontrar alternativas a los mismos. El dióxido de carbono se presenta como una opción y ofrece muchas ventajas en su uso como disolvente. Es no inflamable, no tóxico y no reactivo y se encuentra disponible como un subproducto barato de recuperación en la fabricación de amoniaco y en los pozos de gas natural.1 Además el dióxido de carbono una vez usado puede ser fácilmente recuperado, purificado y reutilizado.
A diferencia de los CFCs y los HCFCs, el dióxido de carbono no contribuye a la reducción de la capa de ozono y a diferencia de los COVs no es un factor de producción de ozono troposférico. Sin embargo, el dióxido de carbono presenta otros efectos negativos para el medio ambiente. Debido a que el dióxido de carbono refleja la radiación infrarroja (calor) hacia la tierra, es un gas de invernadero que contribuye al calentamiento global global warming. Con el fin de considerar al CO2 como una alternativa verde a los COVs y a los disolventes orgánicos halogenados, una vez usado deberá ser reciclado. El dióxido de carbono usado como disolvente, podrá ser recuperado y reutilizado, simplemente permitiendo que el dióxido de carbono líquido o supercrítico se transforme en gas, capturándolo y dejando las impurezas menos volátiles atrás. Este proceso de reciclado requiere muy poca energía ya que el CO2 existe como gas bajo condiciones ambientales. Comparado con los disolventes orgánicos o con el agua, su entalpía de vaporización es considerablemente menor.
Otra consideración a tener en cuenta, a la hora de valorar el uso del dióxido de carbono como disolvente beneficioso para el medio ambiente, es la fuente de CO2. Como se indicó previamente, el dióxido de carbono es un producto de desecho en la fabricación de amoniaco y en los pozos de gas natural, pudiendo ser recuperado de estos procesos. De esta manera no se necesita producir dióxido de carbono, permitiendo darle un buen uso al recuperado en los procesos citados, y evitando con ello su emisión hacia la atmósfera. Muchos de estos factores contribuyen a que el dióxido de carbono sea una alternativa verde de los COVs y los compuestos orgánicos halogenados.
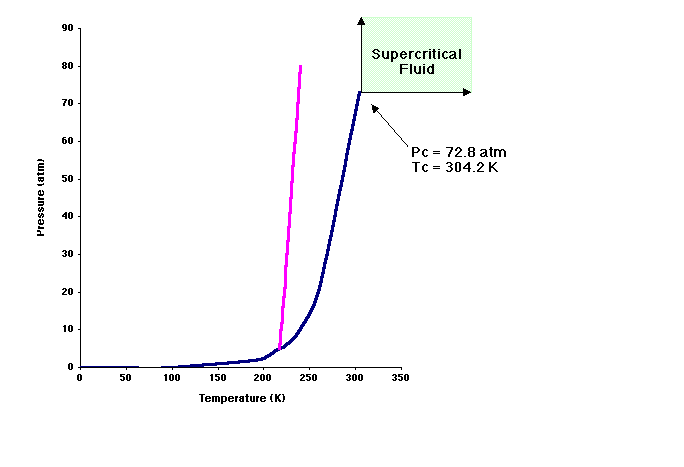
Como se comentó anteriormente, el dióxido de carbono es gas a temperatura y presión ambiente. Para poder usar el CO2 como disolvente debe ser convertido a su estado líquido o como fluido supercrítico. Como se ilustra en el siguiente diagrama de fases, el dióxido de carbono tiene una temperatura supercrítica a (Tc) de 31 °C y una presión supercrítica (Pc) a 72.8 atm. Los fluidos supercríticos tienen propiedades de gases y de líquidos. El CO2 supercrítco se usa actualmente como disolvente para la preparación del café descafeinado.
Solubilidad de las sustancias en el CO2
Aunque el dióxido de carbono tiene enlaces polares, es una molécula no polar ya que los dipolos se anulan mutuamente.
Debido a esta naturaleza no polar, el dióxido de carbono disolverá moléculas no polares más pequeñas como hidrocarburos con menos de 20 átomos de carbono y otras moléculas orgánicas como aldehídos, ésteres y cetonas,2 pero no podrá disolver moléculas más grandes como aceites, ceras, grasas, polímeros, proteínas y moléculas polares. Sin embargo, mediante el empleo de un dispersante, se puede aumentar la solubilidad de muchas sustancias en el CO2 .
Los dispersantes son sustancias que aumentan la solubilidad de una sustancia en otra. Los jabones y detergentes son dispersantes comunes que permiten que emulsionen sustancias no polares, como el aceite y la grasa, y sean lavados por el agua, que es un disolvente polar. De nuestra experiencia diaria, sabemos que el agua y el aceite no se mezclan, debido a su insolubilidad del uno en el otro. Son insolubles porque el aceite es no polar, mientras que el agua es polar, y la regla de la solubilidad es que "lo igual disuelve a lo igual". En otras palabras, los disolventes polares disuelven a los solutos polares, y los disolventes no polares disuelven a los solutos no polares. Un dispersante es una molécula que contiene una parte polar y otra no polar. Al tener ambos grupos dentro de la misma molécula, puede interactuar tanto con las moléculas polares como con las no polares, y por consiguiente aumenta la solubilidad entre dos sustancias, que de otra forma serían insolubles.
En el agua, las moléculas del dispersante tienden a agruparse dando lugar a una geometría esférica con sus terminaciones no polares en el interior de la esfera, y las terminaciones polares en el exterior. A estas agrupaciones se les llaman micelas, y un ejemplo de la misma se muestra en la Figura 4.
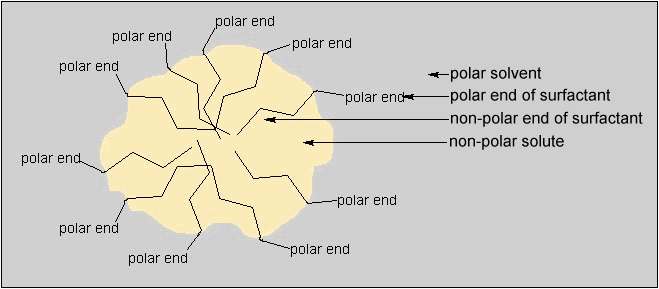
Figura 4. Estructura micelar de un dispersante en un disolvente polar
(impreso con permiso de la Sociedad Americana de Química)
Un dispersante para el CO2 líquido o fluido supercrítico tendrá que tener ambas funciones, un grupo CO2-filico (con tendencia al CO2 ) y otro CO2-fóbico. En 1994, Joseph M. DeSimone de la Universidad de North Carolina y de la Univeridad del Estado de North Carolina publicó su descubrimiento por el cual aquellos polímeros, como los que se muestran en la figura 5, son solubles en el CO2 líquido y fluido supercrítico 3. Este fluorpolímero es soluble en el CO2 debido a sus débiles fuerzas de atracción de van der Waals que existen entre el CO2 y el extremo fluorocarbonado del polímero.
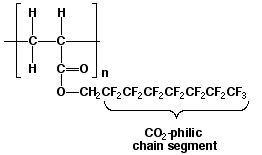
Figura 5. Polímero con un extremo fluorocarbonado CO2-fílico
Los polímeros son moléculas con masas molares muy altas. El agua tiene una masa molar de 18 uma, mientras que los polímeros tienen masas molares que varian desde 10,000 hasta varios millones de uma. El poliestireno es un polímero muy común que tiene como unidad de repetición:
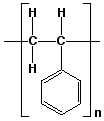
Figura 6. Poliestireno
Esto significa que la unidad que aparece entre corchetes se repite una y otra vez. Más explícitamente, se repite n veces, y llamaremos n al grado de polimerización. Para la mayoría de los polímeros, n > 1000.
El poliestireno se utiliza en una amplia variedad de aplicaciones como envases, por ejemplo, tazas de plástico para bebidas, tapas de plástico, pequeños recipientes para productos tales como bayas o tomates tipo cereza. Como espuma, es comúnmente conocido como estiroespuma, que se usa en las tazas para bebidas calientes, espuma de aislamiento, y los familiares "cacahuetes" que se usan para proteger el embalaje de materiales delicados.
El poliestireno es un polímero quebradizo que con frecuencia se combina con otros polímeros para mejorar sus propiedades. Una de ellas es la de hacer un copolímero. Un copolímero contiene dos tipos de unidades que se repiten en la misma cadena del polímero. Un copolímero no es una mezcla de dos polímeros diferentes, sino que los dos monómeros se enlazan covalentemente a lo largo de la cadena. El copolímero de estireno y acrilonitrilo se utiliza para algunas piezas de automóvil, accesorios (baldas para frigoríficos), artículos médicos y carcasas de baterias.
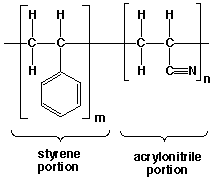
Figure 7. Copolímero de estireno y acrilonitrilo
Los copolímeros pueden existir en una gran variedad de combinaciones. Tres de estas posibles secuencias se muestran a continuación. En estas estructuras, S representa a los monómeros de estireno y A a los de acrilonitrilo.
El polímero que se muestra en la Figura 5 no es muy común, ya que la mayoría de ellos son insolubles en CO2. De hecho, este polímero es uno de los dos únicos solubles en CO2 dentro de los polímeros de elevada masa molar4. Así que para crear un dispersante para el CO2 , DeSimone ha sintetizado copolímeros usando el poliestireno como la fracción CO2-fóbica y el polímero que aparece en la Figura 5 como la fracción CO2-fílica2. La Figura 8 muestra la estructura en bloque de este copolímero, que puede ser representado esquemáticamente como SSSSSSSSAAAAAAA, en donde S= unidades de estireno y A= unidades de fluoracrilatoAl azar SASASAASASSAS
En bloque SSSSSSAAAAAAA
Alternos SASASASASASASA
Figura 8. Copolímero que contiene unidades CO2-fóbicas y CO2-fílicas
Igual que los dispersantes para el agua forman estructuras micelares, así lo hacen los dispersantes para el CO2. La Figura 9 muestra esta estructura micelar de un dispersante para el CO2 , con la fracción CO2-fílica en la parte exterior de la micela. Al igual que los detergentes actúan como dispersantes para la limpieza, usando como disolvente el agua, los dispersantes para el CO2 pueden aumentar la solubilidad de las grasas, cera y aceites en él.
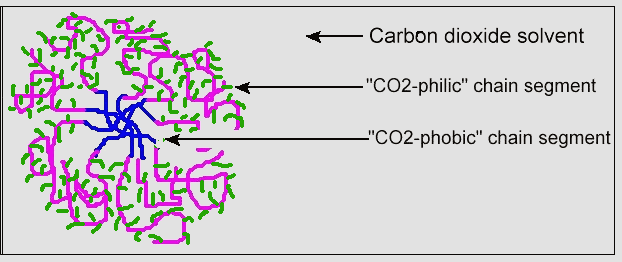
Figura 9. Estructura micelar del dispersante para el CO2
(impreso bajo autorización de la Sociedad Americana de Química)
Uso actual de los dispersantes para el CO2 -- La Química Verde en ACCIÓN
La industria de limpieza en seco utiliza normalmente el disolvente percloroetileno (PERC) como agente de limpieza. Debido a que las prendas de ropa se limpian en una solución líquida constituida principalmente por PERC, y a veces una fracción muy pequeña de agua, se utiliza el término de "limpieza en seco".
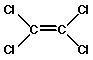
Figura 10. Tetracloroetileno o Percloroetileno (nombre común)
Se estima que en 1998, se produjeron es los Estados Unidos 344 millones de libras de PERC. La industria de limpieza consume aproximadamente el 50% del PERC producido cada año, lo que supone unas 172 millones de libras de este disolvente. La EPA ha clasificado al PERC como un contaminante de las aguas subterráneas y como un peligro potencial para la salud humana. Se sospecha que el PERC es un carcinógeno para el hombre, y se sabe que lo es para los roedores. La inhalación de PERC durante cortos periodos de tiempo pueden afectar de forma adversa al sistema nervioso central. Los efectos causados incluyen vértigos, fatiga, dolor de carbeza, sudores y posiblemente pérdida de la coordinación y del conocimiento. Es posible que estos efectos no tengan lugar a las concentraciones de PERC que normalmente se encuentran en el medio ambiente, pero el personal que trabaja en la industria de limpieza en general presentan el mayor riesgo de exposición.
El uso del PERC en la industria de la limpieza en seco comenzó a finales de 1930. Previo a su uso, los disolventes empleados eran productos procedentes del petróleo como el queroseno, pero debido a su elevada inflamabilidad, eran muy peligrosos de manejar, siendo muy comunes los incendios. Al ser el PERC no inflamable presenta una ventaja significativa frente a los limpiadores derivados del petróleo. Debido al doble enlace que contiene el PERC, se destruye en la troposfera, previniendo con ello que alcance la estratosfera. En consecuencia, a diferencia de muchos otros compuestos orgánicos halogenados, el PERC no contribuye a la destrucción de la capa de ozono. Sin embargo, sí puede contribuir a la formación de la niebla fotoquímica cuando reacciona con los COVs, el óxido de nitrógeno y la radiación solar (Esquema 1).
La compañía Micell Technologies , fundada en 1995 por Joseph DiSimone, Timothy Romack y James McClain, dispusieron comercialmente la tecnología de dispersante para el CO2 . El sistema micelar Micareô consiste en una máquina de lavado comercial que utiliza CO2 y dispersante para el CO2 en vez de PERC, eliminando con ello la necesidad de utilizar un hidrocarburo clorado. La licencia Hangers, utiliza esta tecnología.
La Micell Technologies ha desarrollado también una tecnología conocida como sistema Micleanô para la limpieza de aceites y grasas en componentes metálicos, eliminando de nuevo la necesidad de emplear disoventes halogenados.
El catedrático Professor DiSimone obtuvo un premio de la Presidential Green Chemistry Challenge Award en 1997, por el descubrimiento y desarrollo de los dispersantes para el dióxido de carbono. Ha sido también galardonado con el Premio del Gobernador a la Excelencia, el Premio de la Fundación Nacional de la Ciencia para Jóvenes Investigadores y el Premio de la Presidencia de los Miembros de la Facultad. Además ha recibido, junto con la compañía Micell Technologies, el premio R&D 100, cuando su sistema de limpieza en seco Micareô fue reconocida como uno de los "100 nuevos productos o procesos técnologicamente más significativos del año".

1. Todos contribuimos, de manera directa o indirecta, en la aportación de COVs a la atmósfera. Escriba una lista de algunos de los productos que utiliza, y su contribución (o no) a la reducción de COVs en el aire.
2. La reducción de la capa de ozono estratosférica es muy preocupante, sin embargo la presencia de altos niveles de ozono en las zonas urbanas también son inquietantes. Explique esta aparente contradicción.
3. ¿Qué es la niebla fotoquímica?
4. ¿Cuáles son algunos de los usos de los CFCs y los HCFCs?
5. ¿Cuáles son los pros y los contras de los CFCs?
6. ¿Por qué se han utilizado los HCFCs, de forma temporal, como una alternativa a los CFCs?
7. ¿Cuáles son las limitaciones en el empleo del CO2 líquido o fluido supercrítico como disolvente tal cual, sin otros aditivos? ¿Por qué la combinación del CO2 y el copolímero, descubierto por DeSimone, mejoran la capacidad como disolvente del dióxido de carbono?
8. En el uso del CO2 como disolvente, ¿por qué es importante recuperarlo y no emitirlo a la atmósfera?
9. El copolímero de DeSimone es un copolímro en bloque compuesto por segmentos de la cadena que son CO2 fílicos y otros que son CO2 fóbicos. ¿Cree usted que un copolímero alterno actuaría igual de bien que el copolímero en bloque? ¿Por qué?
10. El poliestireno es un ejemplo de un polímero común. Muchos polímeros contienen el prefijo poli. Escriba una lista de todos los que conozca.
Referencias Bibliográficas
1. DeSimone, Joseph M. Design and Application of Surfactants for Carbon Dioxide, a proposal submitted to the Presidential Green Chemistry Challenge Awards Program, 1997.
2. Hyatt, John A. Liquid and Supercritical Carbon Dioxide as Organic Solvents. J. Am. Chem. Soc. 1986,49, 5097-5101.
3. Guan, Zhibin; DeSimone, J.M. Fluorocarbon-Based Heterophase Polymeric Materials. J.Am. Chem. Soc. 1994, 27, 5527-5532.
4. DeSimone, J.M.; Maury, E,E.; Menceloglu, Y.Z.; McClain, J.B.; Romack, T.J.; Combes, J.R. Dispersion Polymerizations in Supercritical Carbon Dioxide. Science, 1996, 271, 624-626.